Læringsmål
- Forklar, hvorfor kogepunkterne for alkoholer er højere end for ethere og alkaner med samme molarmasse.
- Forklar, hvorfor alkoholer og ethere med fire eller færre kulstofatomer er opløselige i vand, mens tilsvarende alkaner ikke er opløselige.
Alkoholer kan betragtes som derivater af vand (H2O; også skrevet som HOH).

Lige H-O-H-bindingen i vand er R-O-H-bindingen bøjet, og alkoholmolekyler er polære. Dette forhold er særligt tydeligt i små molekyler og afspejles i de fysiske og kemiske egenskaber hos alkoholer med lav molarmasse. Hvis man erstatter et hydrogenatom fra en alkan med en OH-gruppe, kan molekylerne forbinde sig gennem hydrogenbinding (figur \(\PageIndex{1}\)).
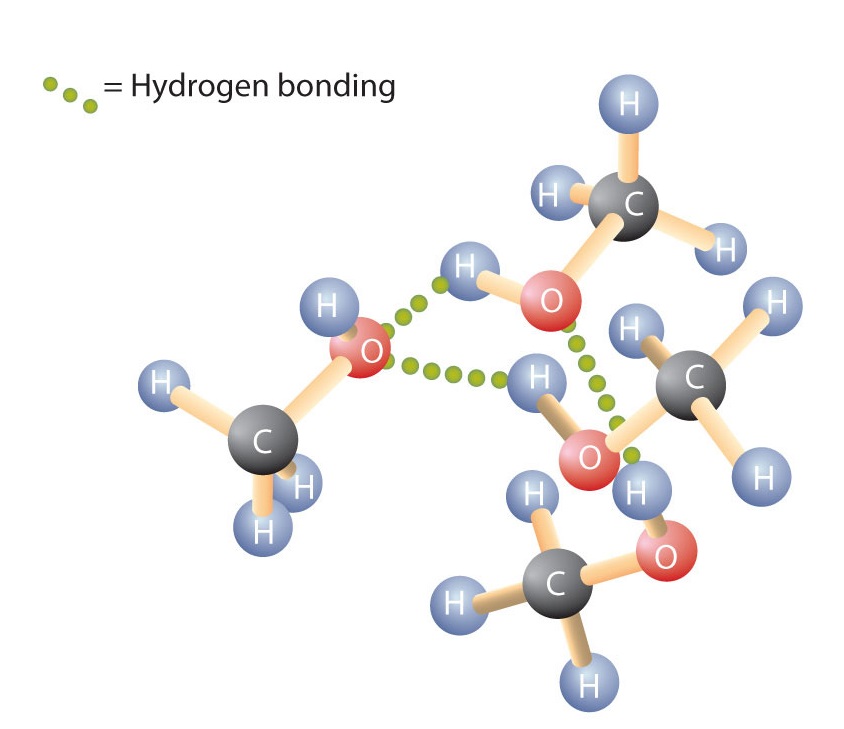
Husk, at fysiske egenskaber i høj grad bestemmes af typen af intermolekylære kræfter. Tabel \(\PageIndex{1}\) viser molarmasserne og kogepunkterne for nogle almindelige forbindelser. Tabellen viser, at stoffer med samme molarmasse kan have meget forskellige kogepunkter.
| Formel | Navn | Molarmasse | Kogningspunkt (°C) | |
|---|---|---|---|---|
| CH4 | metan | 16 | -164 | |
| HOH | vand | 18 | 100 | |
| C2H6 | ethan | 30 | -89 | |
| CH3OH | methanol | 32 | 65 | |
| C3H8 | propan | 44 | -42 | |
| CH3CH2OH | ethanol | 46 | 78 | |
| C4H10 | butan | 58 | 58 | -1 |
| CH3CH2CH2CH2OH | 1-propanol | 60 | 60 | 97 |
Alkaner er upolære og er derfor kun forbundet gennem relativt svage dispersionskræfter. Alkaner med et til fire kulstofatomer er gasser ved stuetemperatur. I modsætning hertil er selv methanol (med ét kulstofatom) en væske ved stuetemperatur. Hydrogenbinding øger alkoholernes kogepunkt betydeligt i forhold til kulbrinter med tilsvarende molarmasse. Kogepunktet er et groft mål for den mængde energi, der er nødvendig for at adskille et væskemolekyle fra dets nærmeste naboer. Hvis molekylerne interagerer gennem hydrogenbinding, skal der tilføres en relativt stor mængde energi for at bryde disse intermolekylære tiltrækninger. Først da kan molekylet slippe ud af væsken og overgå til gasformig tilstand.
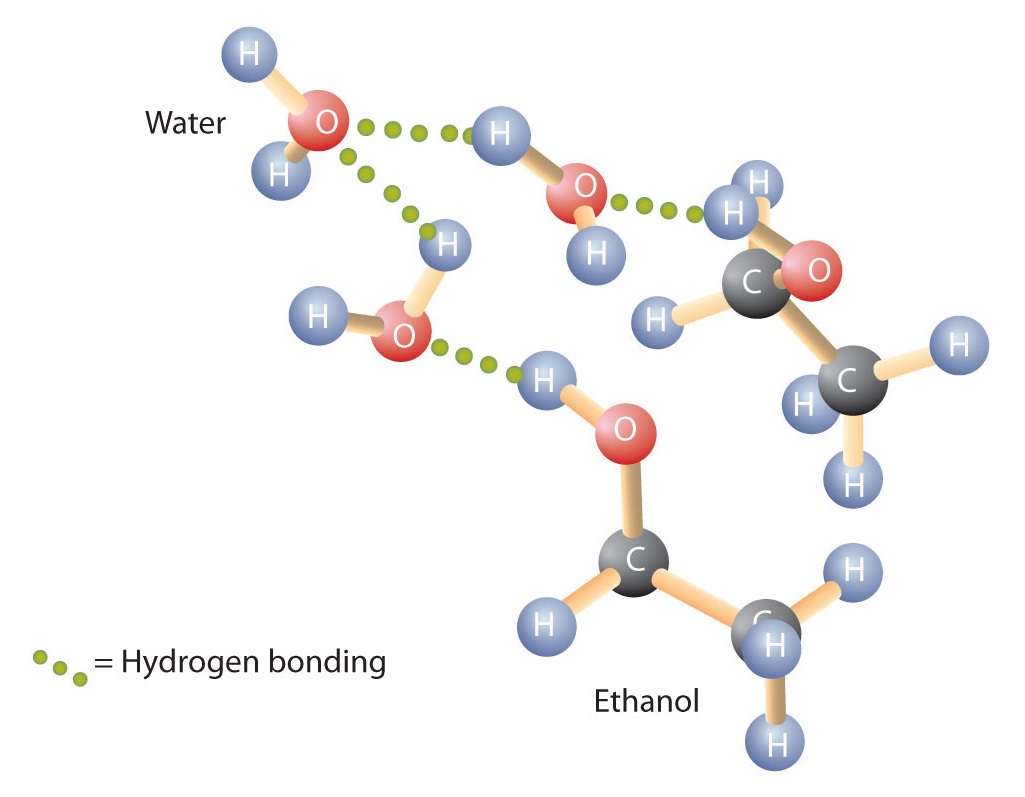
Alkoholer kan også indgå i hydrogenbinding med vandmolekyler (figur \(\PageIndex{2}\)). Mens kulbrinterne således er uopløselige i vand, er alkoholer med et til tre kulstofatomer fuldstændig opløselige. Når kædens længde øges, falder alkoholernes opløselighed i vand imidlertid; molekylerne bliver mere som kulbrinter og mindre som vand. Alkoholen 1-decanol (CH3CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2OH) er stort set uopløselig i vand. Vi finder ofte, at grænsen for opløseligheden i en familie af organiske forbindelser går ved fire eller fem kulstofatomer.
Summary
Alkoholer har højere kogepunkter end ethere og alkaner med samme molarmasse, fordi OH-gruppen gør det muligt for alkoholmolekyler at indgå i hydrogenbinding. Alkoholer med fire eller færre kulstofatomer er opløselige i vand, fordi alkoholmolekylerne indgår i hydrogenbinding med vandmolekyler; tilsvarende alkanmolekyler kan ikke indgå i hydrogenbinding.
Begrebsgennemgang øvelser
-
Hvorfor er ethanol mere opløseligt i vand end 1-hexanol?
-
Hvorfor har 1-butanol et lavere kogepunkt end 1-hexanol?
Svar
-
Ethanol har en OH-gruppe og kun 2 kulstofatomer; 1-hexanol har en OH-gruppe for 6 kulstofatomer og ligner dermed mere et (upolært) kulbrinte end ethanol er.
-
Molmassen af 1-hexanol er større end molenmassen af 1-butanol.
Opgaver
Svar på følgende opgaver uden at konsultere tabeller i teksten.
-
Rangér disse alkoholer i rækkefølge efter stigende kogepunkt: ethanol, methanol og 1-propanol.
-
Hvilken har det højeste kogepunkt – butan eller 1-propanol?
-
Rangér disse alkoholer i rækkefølge efter stigende opløselighed i vand: 1-butanol, methanol og 1-octanol.
-
Rangér disse forbindelser i rækkefølge efter stigende opløselighed i vand: 1-butanol, ethanol og pentan.
Svar
-
methanol < ethanol < 1-propanol
-
1-oktanol < 1-butanol < methanol