Entropi
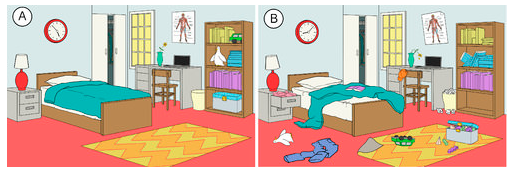
Der er en tendens i naturen til, at systemer bevæger sig mod en tilstand af større uorden eller tilfældighed. Entropi er et mål for graden af tilfældighed eller uorden i et system. Entropi er et let begreb at forstå, når man tænker på hverdagssituationer. Entropien i et rum, der for nylig er blevet rengjort og organiseret, er lav. Efterhånden som tiden går, vil det sandsynligvis blive mere uordentligt, og entropien vil derfor stige (se figuren nedenfor). Den naturlige tendens i et system er, at dets entropi vil stige.
Kemiske reaktioner har også en tendens til at forløbe på en sådan måde, at systemets samlede entropi øges. Hvordan kan man se, om en bestemt reaktion viser en stigning eller et fald i entropien? Reaktanternes og produkternes molekylære tilstand giver visse fingerpeg. De generelle tilfælde nedenfor illustrerer entropien på molekylært niveau.
- For et givet stof er entropien i den flydende tilstand større end entropien i den faste tilstand. På samme måde er entropien for gassen større end entropien for væsken. Derfor øges entropien i processer, hvor faste eller flydende reaktanter danner gasformige produkter. Entropien stiger også, når faste reaktanter danner flydende produkter.
- Entropien stiger, når et stof opdeles i flere dele. Opløsningsprocessen øger entropien, fordi de opløste partikler bliver adskilt fra hinanden, når der dannes en opløsning.
- Entropien stiger, når temperaturen stiger. En stigning i temperaturen betyder, at partiklerne i stoffet har større kinetisk energi. De partikler, der bevæger sig hurtigere, har mere uorden end partikler, der bevæger sig langsommere ved en lavere temperatur.
- Entropien stiger generelt i reaktioner, hvor det samlede antal produktmolekyler er større end det samlede antal reaktantmolekyler. En undtagelse fra denne regel er, når der produceres en gas fra ikke-gasformige reaktanter.
Eksemplerne nedenfor skal tjene til at illustrere, hvordan entropiforandringen i en reaktion kan forudsiges.
\(\ce{Cl_2} \left( g \right) \rightarrow \ce{Cl_2} \left( l \right)\)
Entropien aftager, fordi en gas bliver til en væske.
\(\ce{CaCO_3} \left( s \right) \rightarrow \ce{CaO} \left( s \right) + \ce{CO_2} \left( g \right)\)
Entropien stiger, fordi der dannes en gas, og antallet af molekyler stiger.
\(\ce{N_2} \left( g \right) + 3 \ce{H_2} \left( g \right) \rightarrow 2 \ce{NH_3} \left( g \right)\)
Entropien er faldende, fordi fire reaktantmolekyler i alt danner to produktmolekyler i alt. Alle er gasser.
\(\ce{AgNO_3} \left( aq \right) + \ce{NaCl} \left( aq \right) \rightarrow \ce{NaNO_3} \left( aq \right) + \ce{AgCl} \left( s \right)\)
Entropien er faldende, fordi der dannes et fast stof af vandige reaktanter.
\(\ce{H_2} \left( g \right) + \ce{Cl_2} \left( g \right) \rightarrow 2 \ce{HCl} \left( g \right)\)
Entropiændringen er ukendt (men sandsynligvis ikke nul), fordi der er lige mange molekyler på begge sider af ligningen, og alle er gasser.