Atommodellen
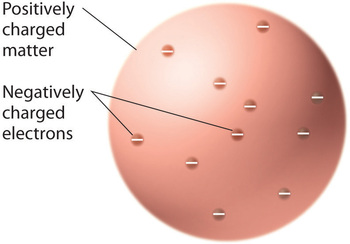
Når forskerne konkluderede, at alt stof indeholder negativt ladede elektroner, blev det klart, at at atomerne, som er elektrisk neutrale, også må indeholde positive ladninger for at opveje de negative. Thomson foreslog, at elektronerne var indlejret i en ensartet kugle, der indeholdt både den positive ladning og det meste af atomets masse, lidt ligesom rosiner i blommepudding eller chokoladestykker i en småkage (Figur \(\PageIndex{9}\))
2.4.6
Figur \(\PageIndex{9}\): Thomsons model af atomet i form af plum pudding eller chokoladekiks. I denne model er elektronerne indlejret i en ensartet kugle med positiv ladning. Billedet er anvendt med tilladelse (CC BY-SA-NC).
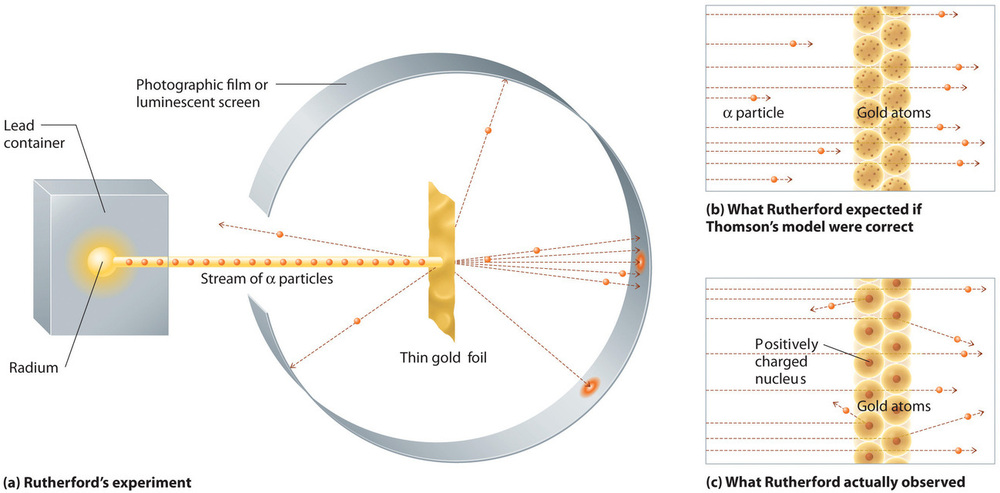
I et enkelt berømt eksperiment viste Rutherford imidlertid utvetydigt, at Thomsons model af atomet var forkert. Rutherford rettede en strøm af α-partikler mod et meget tyndt guldfoliemål (Figur \(\PageIndex{10a}\)) og undersøgte, hvordan α-partiklerne blev spredt af folien. Guld blev valgt, fordi det let kunne hamres i ekstremt tynde plader, hvilket minimerede antallet af atomer i målet. Hvis Thomsons model af atomet var korrekt, skulle de positivt ladede α-partikler styrte gennem guldmålets ensartet fordelte masse som kanonkugler gennem siden af et træhus. De bevægede sig måske lidt langsommere, når de kom ud, men de skulle i det væsentlige passere lige igennem målet (Figur \(\PageIndex{10b}\)))Til Rutherfords forbløffelse blev en lille del af α-partiklerne afbøjet i store vinkler, og nogle blev reflekteret direkte tilbage til kilden (Figur \(\PageIndex{10c}\)). Ifølge Rutherford var “Det var næsten lige så utroligt, som hvis man affyrede en 15-tommer granat mod et stykke silkepapir, og den kom tilbage og ramte en.”
2.4.7
Figur \(\PageIndex{10}\): En oversigt over Rutherfords eksperimenter. (a) En gengivelse af det apparat, som Rutherford brugte til at registrere afbøjninger i en strøm af α-partikler rettet mod et tyndt guldfoliemål. Partiklerne blev produceret af en prøve af radium. (b) Hvis Thomsons model af atomet var korrekt, skulle α-partiklerne have passeret lige igennem guldfolien. (c) Et lille antal α-partikler blev imidlertid afbøjet i forskellige retninger, herunder lige tilbage til kilden. Dette kunne kun være tilfældet, hvis den positive ladning var meget mere massiv end α-partiklen. Det tydede på, at guldatomets masse er koncentreret i et meget lille område af rummet, som han kaldte kernen. Billede anvendt med tilladelse (CC BY-SA-NC).
Rutherfords resultater var ikke i overensstemmelse med en model, hvor massen og den positive ladning er fordelt ensartet i hele atomets volumen. I stedet tydede de stærkt på, at både massen og den positive ladning er koncentreret i en lille brøkdel af et atoms volumen, som Rutherford kaldte kernen. Det gav mening, at en lille brøkdel af α-partiklerne kolliderede med de tætte, positivt ladede kerner enten på en glidende måde, hvilket resulterede i store afbøjninger, eller næsten frontalt, hvilket fik dem til at blive reflekteret direkte tilbage til kilden.
Og selv om Rutherford ikke kunne forklare, hvorfor frastødninger mellem de positive ladninger i kerner, der indeholdt mere end én positiv ladning, ikke fik kernen til at gå i opløsning, ræsonnerede han, at frastødninger mellem negativt ladede elektroner ville få elektronerne til at fordele sig ensartet i hele atomets volumen. i dag ved man, at stærke kernekræfter, som er meget stærkere end elektrostatiske vekselvirkninger, holder protonerne og neutronerne sammen i kernen. For denne og andre indsigter blev Rutherford tildelt Nobelprisen i kemi i 1908. Desværre ville Rutherford have foretrukket at modtage Nobelprisen i fysik, fordi han anså fysik for at være bedre end kemi. Han mente, at “al videnskab er enten fysik eller frimærkesamling.”
 2.4.8
2.4.8
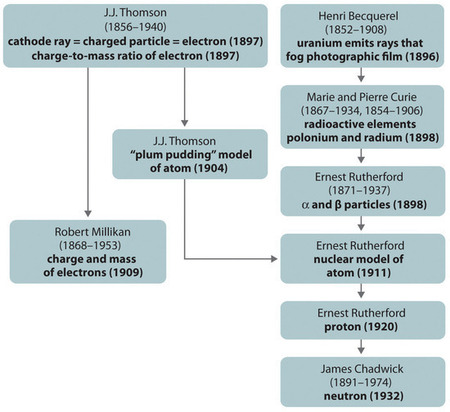
Figur \(\PageIndex{11}\): En oversigt over den historiske udvikling af modellerne for atomets bestanddele og struktur. Datoerne i parentes er de år, i hvilke de vigtigste eksperimenter blev udført. Billedet er anvendt med tilladelse (CC BY-SA-NC).
Den historiske udvikling af de forskellige modeller af atomets struktur er opsummeret i (Figur \(\(\PageIndex{11}\)) Rutherford fastslog, at brintatomets kerne var en positivt ladet partikel, som han i 1920 opfandt navnet proton for. Han foreslog også, at kerner af andre grundstoffer end brint må indeholde elektrisk neutrale partikler med omtrent samme masse som protonerne. Neutronen blev imidlertid først opdaget i 1932, da James Chadwick (1891-1974, en elev af Rutherford; Nobelpris i fysik, 1935) opdagede den. Som følge af Rutherfords arbejde blev det klart, at en α-partikel indeholder to protoner og neutroner, og at den derfor er kernen i et heliumatom.
2.4.9
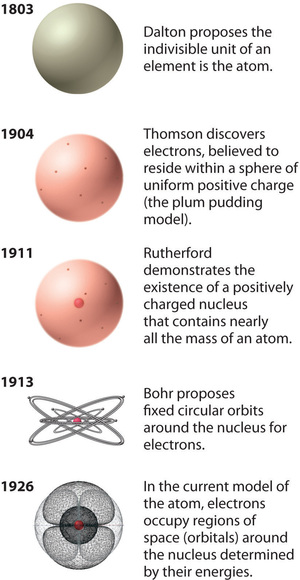
Figur \(\PageIndex{12}\): Atomteoriens udvikling, illustreret ved hjælp af modeller af iltatomet. Bohrs model og den nuværende model er beskrevet i kapitel 6, “Atomernes struktur”. Billedet anvendes med tilladelse (CC BY-SA-NC).
Rutherfords model af atomet er i det væsentlige den samme som den moderne model, bortset fra at man nu ved, at elektronerne ikke er jævnt fordelt i hele atomets volumen. I stedet er de fordelt i henhold til et sæt principper, der er beskrevet af kvantemekanikken. Figur \(\PageIndex{12}\) viser, hvordan atommodellen har udviklet sig over tid fra Daltons udelelige enhed til den moderne opfattelse, som undervises i dag.