Autoimmun hæmolytisk anæmi (AIHA) er medieret af antistoffer, og i de fleste tilfælde er immunoglobulin (Ig) G det medierende antistof. Denne type AIHA betegnes som “varm” AIHA, fordi IgG-antistoffer bindes bedst ved kropstemperatur. “Kold” AIHA formidles af IgM-antistoffer, som binder maksimalt ved temperaturer under 37 °C. AIHA forårsaget af en lægemiddelreaktion er sjælden, med en anslået årlig forekomst på 1:1.000.000 for alvorlig lægemiddelrelateret AIHA.1 Denne artikel gennemgår behandlingen af de mere almindelige typer AIHA med fokus på varm, kold og lægemiddelinduceret AIHA; evaluering og diagnose af AIHA gennemgås i en separat artikel.
Varm autoimmun hæmolytisk anæmi
I AIHA medieres hæmolyse af antistoffer, der binder sig til overfladen af røde blodlegemer. AIHA, hvor IgG-antistoffer er de angribende antistoffer, betegnes som varm AIHA. “Varm” henviser til, at antistoffet binder bedst ved kropstemperatur (37 °C). Ved varm AIHA viser prøverne IgG-molekyler, der er knyttet til overfladen af de røde blodlegemer, og hos 50 % af patienterne er der også C3. Mellem 50 % og 90 % af AIHA-tilfældene skyldes varme antistoffer.2,3 Incidensen af varm AIHA varierer fra serie til serie, men er ca. 1 tilfælde pr. 100.000 patienter pr. år; denne form for hæmolyse rammer hyppigere kvinder end mænd.4,5
Terapeutiske muligheder
First Line
Steroider. Målet med behandlingen ved varm AIHA kan være svært at definere. De fleste vil dog være enige om, at en hæmatokrit på over 30 % (eller højere for at forebygge symptomer) med en minimal stigning i reticulocytantallet – som afspejler en betydeligt bremset hæmolytisk proces – er et rimeligt mål. Den indledende behandling af varm AIHA er prednison i en standarddosis på 1 mg/kg dagligt (tabel 1).6,7 Patienterne bør også startes på protonpumpehæmmere for at forebygge ulcera. Det kan tage op til 3 uger for patienterne at reagere på prednisonbehandling. Når patientens hæmatokrit er over 30 %, nedtrappes prednisonet langsomt. Selv om ca. 80 % af patienterne reagerer på steroiderne, er det kun 30 % af patienterne, der kan aftrappes helt fra steroiderne. For patienter, der kan holdes på en daglig steroiddosis på 10 mg eller mindre, kan steroider være den mest fornuftige langtidsbehandling. Da aktiv hæmolyse fører til et øget behov for folinsyre, ordineres patienter med varm AIHA desuden ofte folinsyre 1 mg dagligt for at forebygge megaloblastisk anæmi på grund af folinsyremangel.
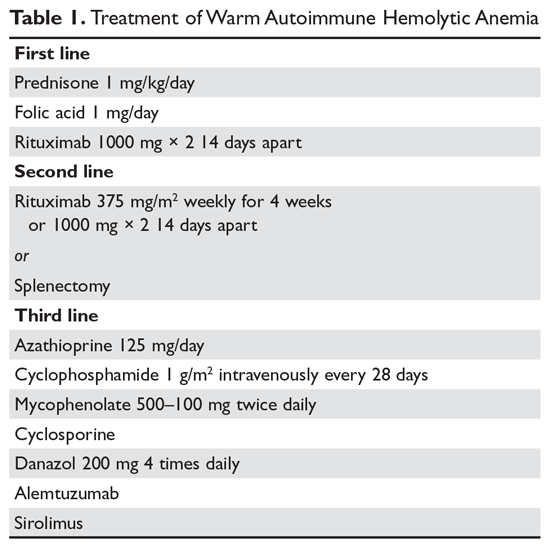
Rituximab. I stigende grad tilføjes rituximab (anti-CD20) behandling til de indledende steroider. To kliniske forsøg viste både øget respons på lang og kort sigt ved brug af rituximab.8,9 En vigtig overvejelse er, at de fleste patienter reagerer gradvist på rituximab over flere uger, så man bør ikke forvente et hurtigt respons. De fleste undersøgelser har anvendt den traditionelle dosering på 375 mg/m2 ugentligt i 4 uger. Disse responser synes at være varige, men ligesom ved immun trombocytopeni (ITP) er gentagen behandling med rituximab effektiv.
De vigtigste bivirkninger ved rituximab er infusionsreaktioner, som ofte er værre ved den første dosis. Disse reaktioner kan kontrolleres med antihistaminer, steroider og, ved alvorlig rigor, meperidin. Sjældent kan patienterne udvikle neutropeni (ca. 1:500), som synes at være autoimmun i naturen. Infektioner synes kun at være minimalt forøget ved brug af rituximab.10 En risikogruppe er kroniske bærere af hepatitis B-virus, som kan opleve en reaktivering af viruset, der kan være fatal. Patienter, der overvejer at få rituximab, skal derfor screenes for hepatitis B-virusbærertilstand.11 Patienter, der modtager rituximab, har en meget lille risiko for progressiv multifokal leukoencefalopati, som er mere almindelig hos patienter med kræft og hos stærkt immunsupprimerede patienter. Den samlede risiko er ukendt, men er mindre end 1:50.000.