Autoregulering af cerebral blodgennemstrømning
Autoregulering af cerebral blodgennemstrømning er hjernens evne til at opretholde en relativt konstant blodgennemstrømning på trods af ændringer i perfusionstrykket . Autoregulering er til stede i mange vaskulære senge, men er særligt veludviklet i hjernen, sandsynligvis på grund af behovet for en konstant blodforsyning og vandhomøostase. Hos voksne normotensive personer opretholdes den cerebrale blodgennemstrømning på ~50 ml pr. 100 g hjernevæv pr. minut, forudsat at CPP ligger i intervallet ~60 til 160 mmHg . Over og under denne grænse går autoreguleringen tabt, og den cerebrale blodgennemstrømning bliver lineært afhængig af det gennemsnitlige arterielle tryk . Når CPP falder under den nedre grænse for autoregulering, opstår der cerebral iskæmi . Reduktionen i den cerebrale blodgennemstrømning kompenseres af en stigning i iltudtrækningen fra blodet . Kliniske tegn eller symptomer på iskæmi ses først, når faldet i perfusionen overstiger den øgede iltudtræknings evne til at opfylde metaboliske behov . På dette tidspunkt opstår der kliniske tegn på hypoperfusion, herunder svimmelhed, ændret mental status og til sidst irreversibel vævsskade (infarkt) .
Mekanismerne for autoregulering i hjernen er ikke helt forstået og er sandsynligvis forskellige ved stigninger vs. fald i trykket. Selv om en rolle for neuronal involvering i autoregulering er tiltalende, har undersøgelser vist, at autoregulering af cerebral blodgennemstrømning er bevaret hos sympatisk og parasympatisk denerverede dyr, hvilket indikerer, at et større bidrag fra extrinsiske neurogene faktorer til autoregulering af cerebral blodgennemstrømning er usandsynligt (se Perivaskulær Innervation). For nylig er der påvist en rolle for neuronalt nitrogenoxid i modulering af cerebral blodstrøms autoregulering, hvilket tyder på, at selv om extrinsisk innervation måske ikke er involveret, kan intrinsisk innervation have en rolle . Man har også foreslået, at biprodukter fra stofskiftet spiller en rolle i autoreguleringen . Reduktion af den cerebrale blodgennemstrømning stimulerer frigivelse af vasoaktive stoffer fra hjernen, der forårsager arteriel dilatation. Kandidater for disse vasoaktive stoffer omfatter H+, K+, O2, adenosin og andre. Autoregulering af hjerneblodgennemstrømningen, når trykket svinger i den høje ende af den autoregulatoriske kurve, skyldes højst sandsynligt den myogene adfærd hos den glatte hjernemuskel, som trækker sig sammen som reaktion på forhøjet tryk og udvider sig som reaktion på nedsat tryk . Det vigtige bidrag fra myogen aktivitet til autoregulering er påvist in vitro i isolerede og tryksatte cerebrale arterier, der indsnævrer sig som reaktion på forhøjet tryk og udvider sig som reaktion på nedsat tryk (se Myogen respons). Autoregulering ved tryk under det myogene trykområde involverer sandsynligvis hypoxi og frigivelse af metaboliske faktorer .
Autoreguleringens betydning for normal hjernefunktion understreges af, at der opstår betydelig hjerneskade, når de autoregulerende mekanismer går tabt. F.eks. under akut hypertension ved tryk over den autoregulatoriske grænse overvindes den myogene indsnævring af den glatte vaskulære muskulatur af det overdrevne intravaskulære tryk, og der sker en tvungen dilatation af hjernekarrene . Tabet af myogenisk tone under den tvungne dilatation mindsker den cerebrovaskulære modstand, hvilket kan medføre en stor stigning i den cerebrale blodgennemstrømning (300-400 %), kendt som autoregulatorisk gennembrud (figur 16). Desuden øger den nedsatte cerebrovaskulære modstand det hydrostatiske tryk på det cerebrale endothel, hvilket forårsager ødemdannelse , den underliggende årsag til tilstande som hypertensiv encephalopati, posterior reversibel encephalopati syndrom (PRES) og eklampsi (se Vasogen ødemdannelse).
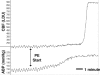
FIGUR 16
Sporing af CBF (i laser Doppler-enheder) og ABP (i mmHg) som reaktion på stigende doser af PE. I dette eksperiment steg CBF fire gange mere end baseline, da ABP steg fra 140 til 210 mmHg, hvilket viser et autoregulatorisk gennembrud. Anvendt (mere…)
Men selv om det er ualmindeligt siden fremkomsten af effektiv antihypertensiv behandling, opstår hypertensiv encephalopati som følge af en pludselig, vedvarende stigning i blodtrykket, der er tilstrækkelig til at overskride den øvre grænse for autoregulering af den cerebrale blodgennemstrømning (>160 mmHg) . Tidlige undersøgelser af hjernekarrenes reaktion på højt blodtryk førte til begrebet hypertensiv vasospasme. Akut hypertensiv encephalopati blev anset for at være resultatet af spasmer-;defineret som en ukontrolleret vasokonstriktion-;af hjernearterierne, der forårsager iskæmi af hjernevævet . Dette koncept stammer fra Byroms observationer, hvor han fremstillede eksperimentel renal hypertension og konstaterede, at ~90% af de hypertensive rotter med neurologiske manifestationer viste flere kortikale pletter af trypanblå ekstravasation, mens rotter uden cerebrale symptomer syntes at have normal cerebrovaskulær permeabilitet. Han bemærkede også, hvad han kaldte en vekslende vasokonstriktion/vasodilation i de piale kar, et fænomen, der er kendt som et “pølsesnor”-udseende. Denne observation førte ham til den konklusion, at cerebral vasospasme forårsagede iskæmi og ødemdannelse som reaktion på akut hypertension. Byrom ændrede senere sit synspunkt og henviste til et fund i det mesenteriske kredsløb, hvor kar med dette “pølsesnor”-udseende kun havde proteinlækage i de udvidede dele af karrene . Siden da er det blevet fastslået, at højt blodtryk resulterer i øget cerebral blodgennemstrømning og “gennembrud af autoregulering” . Yderligere eksperimenter bekræftede, at tab af myogenisk vasokonstriktion under tvungen dilatation snarere end spasmer er den kritiske begivenhed i hypertensiv encephalopati .