Indledning
Bugspytkirtelkræft vil typisk henvise til duktalt karcinom i bugspytkirtlen, som udgør op til 90 % af de primære maligniteter i bugspytkirtlen. Det resterende antal kan opdeles i exokrine tumorer (som f.eks. pancreascystisk karcinom) og endokrine tumorer (der stammer fra bugspytkirtlens ø-celler).
Pancreaskræft har en høj dødelighed og er den fjerde mest almindelige årsag til kræftdød i Storbritannien. Den er sjælden under 40 år, og 80 % af tilfældene forekommer i alderen 60-80 år. Den diagnosticeres sjældent tidligt nok til kurativ behandling.
I denne artikel skal vi se på risikofaktorer, undersøgelser og behandling af en patient med pancreaskræft.
Patofysiologi
Den mest almindelige type pancreaskræft er duktalt karcinom (90 % af de primære maligniteter i pancreas). Andre sjældnere former omfatter bl.a. cystiske tumorer, ampullære celletumorer og isletcelletumorer, som alle ofte har en meget bedre prognose.
Når kræften spreder sig, involverer den direkte invasion af lokale strukturer typisk milten, det tværgående kolon og binyrerne. Lymfatisk metastase involverer typisk regionale lymfeknuder, lever, lunger og peritoneum. Metastaser er almindelige på diagnosetidspunktet.
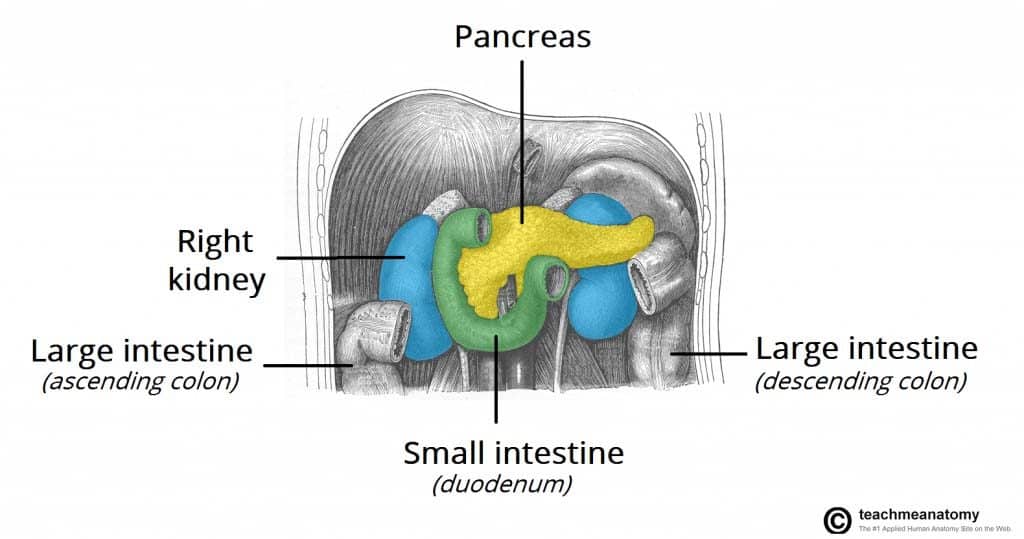 Figur 1 – Bugspytkirtelkræft kan sprede sig direkte til omkringliggende strukturer, såsom milt, tværgående tyktarm og binyrebark.
Figur 1 – Bugspytkirtelkræft kan sprede sig direkte til omkringliggende strukturer, såsom milt, tværgående tyktarm og binyrebark.Risikofaktorer
Der er kun få klare risikofaktorer for udvikling af karcinom i bugspytkirtlen. De, der er blevet identificeret, omfatter rygning og kronisk pancreatitis. Der kan også være et arveligt element, da 7 % af patienterne har en familiehistorie med sygdommen.
Spålidt indsættende diabetes mellitus er en yderligere risikofaktor. Personer, der diagnosticeres med diabetes >50 år, har 8 gange større risiko for at udvikle pancreascarcinom i de følgende tre år end den generelle befolkning.
Klinisk præsentation
Omkring 80 % af tilfældene af pancreascarcinom er ikke-resektable ved diagnosen, hvilket vidner om den sene og ofte vage og uspecifikke karakter af præsentationen.
De specifikke kliniske træk* kan afhænge af tumorens placering:
- Obstruktiv gulsot – på grund af kompression af den almindelige galdegang (til stede i 90 % af tilfældene på diagnosetidspunktet), typisk smertefri
- Vægttab – på grund af kræftsygdommens metaboliske virkninger, eller sekundært til exokrin dysfunktion
- Abdominalsmerter (uspecifikke) – på grund af invasion af plexus coeliacus eller sekundært til pancreatitis
Mindre almindelige præsentationer omfatter akut pancreatitis eller thrombophlebitis migrans (en tilbagevendende migrerende overfladisk tromboflebitis, forårsaget af en paraneoplastisk hyperkoagulabel tilstand).
*Tumorer i pancreashaler har et snigende forløb og er ofte ikke symptomatiske før i et sent stadie
Patienterne kan ved undersøgelse fremstå kachektiske, underernærede og gulsot. Ved palpation kan man føle en abdominal masse i den epigastriske region samt en forstørret galdeblære (i henhold til Courvoisiers lov)
Courvoisiers lov
Courvoisiers lov siger, at ved tilstedeværelse af gulsot og en forstørret/palpbar galdeblære, bør der være stærk mistanke om malignitet i galde- eller bugspytkirteltræet, da det er usandsynligt, at årsagen er galdesten.
Dette tegn kan være til stede, hvis den obstruerende tumor er distalt i forhold til blærehalskanalen. I virkeligheden er en forstørret galdeblære til stede hos mindre end 25 % af patienter med pancreascancer.
Differentialdiagnostik
Pancreascancer viser sig ofte med vage, uspecifikke træk. Differentialdiagnoserne er omfattende og omfatter bl.a:
- Årsager til obstruktiv gulsot – galdestenssygdom, kolangiokarcinom, benign galdeblæreforsnævring
- Årsager til epigastriske mavesmerter – galdesten, mavesårssygdom, gastrisk karcinom, akut koronart syndrom
Undersøgelser
Laboratorieundersøgelser
Alle mistanker om pancreascancer bør berettige indledende blodprøver, herunder FBC (anæmi eller trombocytopeni) og LFT’er (forhøjet bilirubin, alkalisk fosfatase og gamma-GT, der viser et obstruktivt gulsotbillede).
CA19-9 er en tumormarkør med en høj sensitivitet og specificitet for pancreascancer, men dens rolle er at vurdere respons på behandling snarere end til initial diagnose.
Billeddannelse
Den indledende billeddannelse for pancreascancer er almindeligvis en abdominal ultralyd, som kan påvise en pancreasmasse eller et dilateret galdetræ (samt potentielle levermetastaser og ascites, hvis sygdommen er i et meget sent stadium).
CT-billeddannelse (ved hjælp af en pancreasprotokol, fig. 2) er både den vigtigste undersøgelse med hensyn til diagnose, men også den mest prognostisk informative, da den kan stadieinddele sygdomsprogressionen. En CT-scanning af bryst-abdomen-pelvis vil yderligere være påkrævet, når bugspytkirtelkræft er blevet diagnosticeret med henblik på stadieinddeling; en PET-CT-scanning kan være berettiget hos personer med lokaliseret sygdom på CT, som skal have kræftbehandling
Endoskopisk ultralyd (EUS) kan efterfølgende anvendes til at lede finnålsaspirationsbiopsi med henblik på histologisk evaluering af læsionen, hvis diagnosen stadig er uklar. ERCP kan også anvendes til at få adgang til læsionen med henblik på biopsi eller cytologi, hvis den befinder sig på et egnet sted*.
*En galdebørstning med henblik på cytologi, hvis ERCP anvendes til at afhjælpe galdeobstruktion, og der ikke er nogen vævsdiagnose.
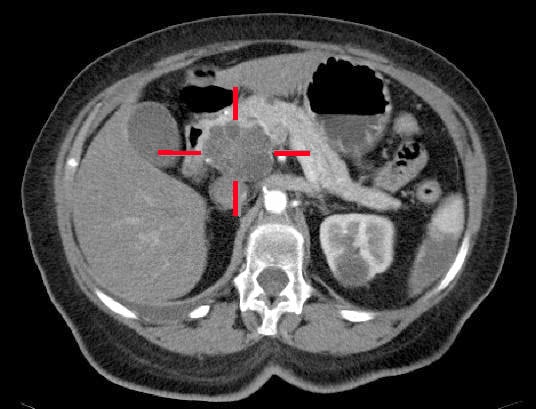 Figur 2 – Et adenokarcinom lokaliseret i pancreashovedet, identificeret ved CT-scanning
Figur 2 – Et adenokarcinom lokaliseret i pancreashovedet, identificeret ved CT-scanningBehandling
Kirurgi
Den eneste kurative behandlingsmulighed er i øjeblikket radikal resektion:
- For patienter med tumorer i hovedet af bugspytkirtlen er den mest almindelige operation med kurativ hensigt pancreasoduodenektomi, også kendt som Whipple-procedure
- Pylorusbevarende resektioner kan forsøges i visse tilfælde
- For patienter med tumorer i kroppen eller halen af bugspytkirtlen:
- For patienter med tumorer i kroppen eller halen af bugspytkirtlen, kan der ofte foretages en distal pancreatectomi
Absolutte kontraindikationer for kirurgi omfatter peritoneal-, lever- og fjernmetastaser. Der er en høj morbiditet forbundet med disse procedurer (op til 40 %), og specifikke komplikationer omfatter dannelse af en pancreasfistel, forsinket gastrisk tømning og pancreasinsufficiens.
En Cochrane-gennemgang fandt, at pancreasresektion øger overlevelsen og reducerer omkostningerne sammenlignet med palliative behandlinger hos patienter med lokalt fremskreden pancreaskræft og venøs involvering, forudsat at der er tilstrækkelig klinisk ekspertise til rådighed.
Whipples procedure
En Whipples procedure indebærer fjernelse af bugspytkirtelhovedet, mavens antrum, 1. og 2. del af duodenum, den almindelige galdegang og galdeblæren.
Alle viscera fjernes ved operationen på grund af deres fælles arterielle forsyning (den gastroduodenale arterie), som bugspytkirtelhovedet og tolvfingertarmen deler med hinanden.
Derpå fæstnes bugspytkirtelhalen og levergangen til jejunum, så galde og bugspytkirtelsaft kan løbe ud i tarmen, mens mavesækken efterfølgende anastomoseres med jejunum, hvilket giver mulighed for passage af mad.
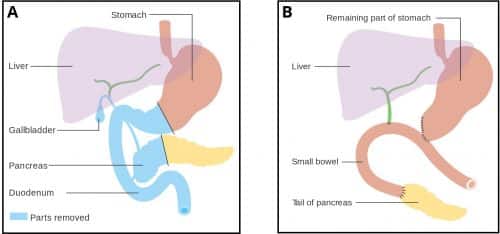 Figur 3 – Pancreasoduodenektomi (Whipple’s procedure). A: Før proceduren, B: Efter proceduren
Figur 3 – Pancreasoduodenektomi (Whipple’s procedure). A: Før proceduren, B: Efter proceduren
Kemoterapi
Adjuverende kemoterapi, generelt med 5-flouracil, anbefales efter operationen, da det er blevet påvist, at det forbedrer overlevelsen efter ESPAC-1-forsøget*.
I metastatisk sygdom anbefales brugen af FOLFIRINOX-regimet (folinsyre, 5-fluorouracil, irinotecan og oxaliplatin) til personer med god præstationsstatus, men har dog kun givet beskedne forbedringer i overlevelsen; behandling med gemcitabin kan overvejes til personer med lokalt fremskreden bugspytkirtelkræft, som ikke er raske nok til at tåle FOLFIRINOX.
*ESPAC-1 viste også, at patienter, der blev behandlet med adjuverende kemoradioterapi, havde generelt dårligere resultater end patienter, der blev behandlet med adjuverende kemoterapi alene.
Palliativ behandling
De fleste patienter med pancreascancer er ikke kandidater til kurativ kirurgi, men har i stedet brug for inddragelse af den palliative behandling.
Obstruktiv gulsot og tilknyttet pruritis kan lindres ved indsættelse af en galdevejsstent, enten via ERCP eller perkutant.
Palliativ kemoterapi, f.eks. med et gemcitabinbaseret regime, kan afprøves hos patienter med en rimelig præstationsstatus.
Exokrin insufficiens er almindelig ved fremskreden sygdom eller hos dem, der har fået foretaget en betydelig excision af bugspytkirtlen, hvilket fører til malabsorption og steatorrhoe; dette kan i første omgang behandles med enzymerstatninger (herunder lipaser), såsom Creon®.
Prognose
Pankreaskræft har en høj metastatisk kapacitet, selv i små tumorer. Prognosen for bugspytkirtelkræft er fortsat meget dårlig med en samlet 5-års overlevelsesrate <5%.
Nøglepunkter
- Pancreascancer vil ofte præsentere sig med en kombination af obstruktiv gulsot, mavesmerter eller vægttab
- De fleste tilfælde opdages i første omgang ved CT-scanning, men kræver dog vævsdiagnostik ved biopsi; CA19-9 er en tumormarkør, der anvendes til overvågning af sygdomsprogression
- Den definitive behandling er kirurgisk resektion, ofte med adjuverende kemoterapi
- Pankreaskræft har en 5-års overlevelsesrate på under 5 %
Endokrine tumorer i bugspytkirtlen
Endokrine tumorer i bugspytkirtlen kan være funktionelle eller ikke-funktionelle. Funktionelle tumorer udskiller aktivt hormoner, og deres tegn og symptomer er relateret hertil, mens ikke-funktionelle tumorer ikke udskiller aktive hormoner, og de kliniske træk er udelukkende relateret til deres maligne spredning.
Endokrine tumorer i bugspytkirtlen er ofte forbundet med multipel endokrin neoplasi 1 syndrom (MEN1); MEN1 består typisk af hyperparathyroidisme, endokrine pancreastumorer og hypofysetumorer (oftest prolaktinomer).
Kliniske træk
| Celletype | Sekreted Hormone (navn på tumoren) | Normal fysiologisk funktion | Funktionelle tumors kendetegn |
| G-celler | Gastrin (gastrinom) | Stimulerer frigivelse af mavesyre | Zollinger-Ellison syndrom, resulterer i alvorlige mavesår, der er refraktære over for medicinsk behandling, med diarré og steatorrhoea |
| α-celler | Glucagon (Glucagonoma) | Stigning af blodglukosekoncentrationen | Hyperglykæmi, diabetes mellitus, og nekrolytisk migrerende erythem |
| β-celler | Insulin (insulinom) | Sænkning af blodglukosekoncentrationen | Symptomatisk hypoglykæmi, såsom svedtendens eller ændret mental tilstand, forbedres ved indtagelse af kulhydrater |
| δ Celler | Somatostatin (Somatostatinom) | Hæmmer frigivelsen af GH, TSH og prolaktin fra den forreste hypofyse og af gastrin | Diabetes mellitus, steatorrhoea, galdesten (på grund af hæmning af cholecystokininin), vægttab, og achlorhydri (på grund af gastrinhæmning) |
| Non-islet-celler | Vasoaktivt intestinal peptid (VIPoma) | Sekretion af vand og elektrolytter i tarmen. Afslapning af enterisk glat muskulatur. | Langvarig profus vandig diarré, alvorlig hypokalæmi og dehydrering (også kendt som Verner-Morrison syndrom) |
Tabel 1 – Endokrine tumorer i pancreas
Udredning
Alle tilfælde bør diskuteres på et tværfagligt teammøde, hvor behandlingen kan styres. Visse blodprøver kan sendes, afhængigt af den mistænkte subtype (Tabel 1)
Pancreas NET’er undersøges bedst med en kombination af CT-billeddannelse, MRI-billeddannelse og/eller endoskopisk ultralyd. Intraarteriel calcium med digital subtraktionsangiografi kan også anvendes til lokalisering og vurdering af insulinomer og gastrinomer.
Behandling
Små ikke-funktionelle veldifferentierede pancreatiske NET’er (<1 cm) kan blot observeres. Større eller fungerende tumorer reseceres, og eventuel fjernmetastatisk sygdom reseceres også, hvis tumoren er af lav grad og metastaserne har et lille volumen.
Somatostatinanaloger kan anvendes til at kontrollere og afhjælpe virkningerne af hormonel hypersekretion (selv i tilfælde af somatostatinomer).