Det kemiske grundstof helium er klassificeret som en ædelgas og et ikke-metal. Det blev opdaget i 1895 af William Ramsay.

Datazone
| Klassifikation: | Helium er en ædelgas og et ikke-metal |
| Farve: | farveløs |
| Atomatisk vægt: | 4.00260 |
| Status: | gas |
| Smeltepunkt: | -272,2 oC, 0,95 K |
| Bemærkning: Ved normalt atmosfærisk tryk størkner helium ikke og har derfor intet smeltepunkt. Det ovenfor angivne smeltepunkt er ved et tryk på 25 atmosfærer. | |
| Skoldningspunkt: | -268,9 oC, 4.2 K |
| Elektroner: | 2 |
| Protoner: | 2 |
| Neutroner i den hyppigst forekommende isotop: | 2 |
| Elektronskaller: | 2 |
| Elektronkonfiguration: | 1s2 |
| Densitet @ 20oC: | 0.0001787 g/cm3 |
Vis flere, herunder: Varme, energi, oxidation,
Reaktioner, forbindelser, radier, ledningsevner
| Atomvolumen: | 27,2 cm3/mol |
| Struktur: | normalt sekskantet tætpakket |
| (v.højt tryk, der er nødvendigt for at størkne helium) | |
| Specifik varmekapacitet | 5.193 J g-1 K-1 |
| Fusionsvarme | 0.0138 kJ mol-1 |
| Forstøningsvarme | 0 |
| Fordampevarme | 0.0845 kJ mol-1 |
| 1. ioniseringsenergi | 2372.3 kJ mol-1 |
| 2. ioniseringsenergi | – |
| 3. ioniseringsenergi | – |
| Elektronaffinitet | 0 kJ mol-1 |
| Minimalt oxidationstal | 0 |
| Min. fælles oxidationsnr. | 0 |
| Maksimalt oxidationstal | 0 |
| Maks. fælles oxidationsnr. | 0 |
| Elektronegativitet (Pauling-skala) | – |
| Polarisérbarhedsmængde | 0.198 Å3 |
| Reaktion med luft | ingen |
| Reaktion med 15 M HNO3 | ingen |
| Reaktion med 6 M HCl | ingen |
| Reaktion med 6 M NaOH | ingen |
| Oxid(er) | ingen |
| Hydrid(er) | ingen |
| Chlorid(er) | ingen |
| Atomradius | 31 pm |
| Ionisk radius (1+ ion) | – |
| Ionisk radius (2+ ion) | – |
| Ionisk radius (3+ ion) | – |
| Ionisk radius (1- ion) | – |
| Ionisk radius (2-ion) | – |
| Ionisk radius (3-ion) | – |
| Varmeledningsevne | 0.15 W m-1 K-1 |
| Elektrisk ledningsevne | – |
| Frost-/smeltepunkt: | -272,2 oC, 0.95 K |

Nasa: Ioniserede heliumatomer ved ca. 60.000 °C i Solens kromosfære udsender det ultraviolette lys, der ses på dette billede.
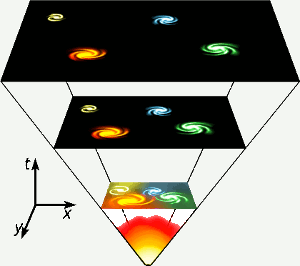
Helium blev fremstillet i de første tre minutter af universets eksistens, da temperaturen overalt var høj nok til, at der kunne ske kernefusion. Denne korte, højenergifase er repræsenteret helt nede i bunden af diagrammet. Helium fremstilles også ved kernefusion af brint i stjerner som vores egen. Billede: Gnixon
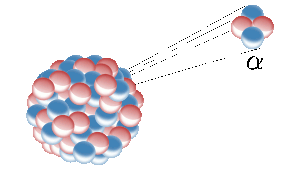
Helium på jorden kommer fra kernespaltning af radioaktive grundstoffer som f.eks. uran. Her udsender en radioaktiv kerne en heliumkerne (også kendt som en alfapartikel). Billede: Inductiveload

Heliums spektrum med fremtrædende gul linje. Billede: Billede: Nasa

William Ramsay peger på det periodiske systems sidste kolonne med de ædle (eller inerte) gasser. Ramsay fik Nobelprisen i kemi i 1904 for sit arbejde med opdagelsen af de inerte gasser. Image: Vanity Fair
Offentliggørelse af helium
Historien om heliums opdagelse er sammenvævet med opdagelsen af stjernernes natur.
På et tidspunkt troede folk, at vi aldrig ville få at vide, hvad stjerner er lavet af. I 1835 erklærede den franske filosof Auguste Comte, at “vi aldrig vil være i stand til på nogen måde at studere deres kemiske sammensætning”. (1)
Comte mente, at vi kun kunne lære, hvad stjernestof var, hvis vi kunne få det ind i laboratoriet.
På trods af Comtes pessimisme havde man allerede fundet metoden til at finde frem til helium og stjernernes sammensætning. I 1814 havde den tyske fysiker Joseph Fraunhofer taget Isaac Newtons metode til at splitte sollyset ved hjælp af et prisme til sig og havde gjort et afgørende fremskridt. Fraunhofer havde bemærket mørke linjer i den regnbue af farver, der kom fra sollyset, som blev delt af et prisme; de linjer, han så, var den første observation nogensinde af en stjernes spektrum. (2), (3)
I 1859/60 foretog de tyske videnskabsmænd Gustav Kirchhoff og Robert Bunsen enorme spring i spektroskopividenskaben, herunder opdagelsen af, at de mørke linjer, som Fraunhofer havde set, var som et stofs fingeraftryk.
Scenen var sat for Kirchhoff og Bunsen til at opdage nye grundstoffer ved at studere lys fra stoffer, når de brændte.
I 1860 opdagede de cæsium ved hjælp af dets blå spektrallinjer og i 1861 rubidium ud fra to røde spektrallinjer. Derefter opdagede William Crookes thallium i 1861 efter at have observeret en lys grøn spektrallinie.
Kirchhoff og Bunsen så på solens spektrum og kunne konkludere, at der var jern i dens glødende atmosfære. (4)
Til heliums opdagelse skulle der gå endnu et par år. I august 1868 skulle den første totale solformørkelse, siden Kirchhoff og Bunsens arbejde var blevet offentliggjort, finde sted.
Den franske astronom Pierre Janssen ventede på en solformørkelse for at kunne observere prominenserne i solens korona ved hjælp af et spektroskop. I de to uger efter solformørkelsen udviklede Janssen en metode til at registrere prominenternes spektrer uden behov for en solformørkelse. I disse spektrer observerede han en gul linje. (5)
Linjen var i en lignende, men ikke identisk position med linjer i natriums spektrum. Disse blev kaldt D1- og D2-linjerne. Den engelske videnskabsmand Norman Lockyer studerede den nye gule linje; senere skulle den kaldes D3-linjen. han offentliggjorde sin undersøgelse af linjen, velvidende at den kunne skyldes et nyt grundstof:
“…så da vidste vi, at vi ikke havde med brint at gøre; derfor havde vi at gøre med et grundstof, som vi ikke kunne få i vores laboratorier, og derfor påtog jeg mig selv ansvaret for at præge ordet helium, i første omgang til laboratoriebrug.” (6)
Navnet helium kom fra det græske ord for solen, helios.
Lockyer og Edward Frankland, hans kollega, havde en række andre ideer om de mulige årsager til den gule streg og annoncerede derfor ikke et nyt grundstof.
I 1871 var andre videnskabsmænd klar over situationen. Lord Kelvin diskuterede “refleksion af lyset fra den glødende brint og ‘helium’ omkring solen”. Brugen af ‘helium’ efterfølges af en fodnote, der forklarer det:
“Frankland og Lockyer finder, at de gule prominenserne giver en meget decideret lys linje ikke langt fra D, men hidtil ikke identificeret med nogen jordisk flamme. Den synes at indikere et nyt stof, som de foreslår at kalde Helium.” (7)
Heliums eksistens blev dog ikke accepteret af alle. (5)
Al tvivl blev fjernet, da den skotske kemiker William Ramsay isolerede helium i 1895 i London. Ramsay havde medopdaget argon i 1894; argon var den første af ædelgasserne, der blev opdaget. I 1895 læste han en artikel af William Hillebrand, der beskrev en ureaktiv gas, som blev frigivet, når man tilsatte syre til uranmineralet uranit. Hillebrand mente, at gassen var nitrogen.
Ramsay, som mente, at gassen kunne indeholde argon, gentog Hillebrands forsøg med et andet uranmineral, cleveit, og opsamlede gassen.
Hans spektroskop viste tilstedeværelsen af nitrogen, argon og en anden gas. Ramsay mistænkte, at det kunne være helium, fordi der syntes at være en D3-linje. (8) Da han var klar over, at Lockyer og William Crookes havde et bedre spektroskop end hans, sendte han dem en prøve af gassen. Desværre var prøven ikke egnet, så Lockyer skaffede en prøve af uranit, ekstraherede gassen og undersøgte den med spektroskop. Han skriver: (8)
“En efter en viste de ukendte linjer, som jeg havde observeret i solen i 1868, sig at tilhøre gassen.”
Gassens spektrum var identisk med solens ‘helium’. Et nyt grundstof vandt sin plads i det periodiske system.
Besøg Chemicool’s Cool Helium Facts Page.

Udseende og karakteristika
Skadelige virkninger:
Helium er ikke kendt for at være giftigt.
Egenskaber:
Helium er en let, lugtfri, farveløs, inert, monatomisk gas. Det kan danne diatomare molekyler, men kun svagt og ved temperaturer tæt på det absolutte nulpunkt.
Helium har det laveste smeltepunkt af alle grundstoffer, og dets kogepunkt er tæt på det absolutte nulpunkt.
I modsætning til alle andre grundstoffer størkner helium ikke, men forbliver flydende ned til det absolutte nulpunkt (0 K) under almindeligt tryk.
Stemmen hos en person, der har indåndet helium, lyder midlertidigt højlydt.
Anvendelser af helium
Magnetisk resonansafbildning (MRI) er den største bruger af helium. Heliumet bruges til at køle MRI-skannernes superledende magneter.
Helium bruges til at fylde balloner (blimps) og til at sætte tryk på raketter med flydende brændstof.
Blandinger af helium og ilt bruges som kunstig “luft” til dykkere og andre, der arbejder under tryk. Helium anvendes i stedet for nitrogen i normal luft, fordi helium efter et langt dyk forlader kroppen hurtigere end nitrogen, hvilket muliggør en hurtigere dekompression.
Helium anvendes som gasbeskyttelse i nærheden af lysbuesvejsning for at forhindre f.eks. enhver reaktion af varme metalsvejsninger med oxygen. Gassen anvendes i halvlederindustrien til at skabe en inert atmosfære til dyrkning af silicium- og germaniumkrystaller. Den anvendes også som højtemperaturgas ved fremstilling af titanium og zirconium og som bæregas i gaskromatografi.
Forsyning og isotoper
Forsyning jordskorpen: 8 vægtdele pr. milliard, 43 vægtdele pr. milliard i mol
Forsyning solsystemet: 23 % i vægt, 7,4 % i mol
Omkostninger, ren: 5,2 $ pr. 100 g
Omkostninger, bulk: $ pr. 100 g
Kilde: Næsten alt helium på Jorden er resultatet af radioaktivt henfald. De største kilder til helium stammer fra naturgasforekomster i brønde i Texas, Oklahoma og Kansas. Helium udvindes ved fraktioneret destillation af naturgassen, som indeholder op til 7 % helium.
Isotoper: Helium har 8 isotoper, hvis halveringstider er kendt, med massetal 3 til 10. Naturligt forekommende helium er en blanding af dets to stabile isotoper, 3He og 4He med naturlige hyppigheder på henholdsvis 0,0001% og 99,999%.

- Auguste Comte, Cours de Philosophie Positive at Project Gutenberg
- Keith J. Laidler, The World of Physical Chemistry, 1993, s179.
- The Era of Classical Spectroscopy, fra MIT Spectroscopy.
- Gerard G. Emch, Mathematical and Conceptual Foundations of 20th-Century Physics. 1984, Elsevier Science Publishers, s211
- Helge Kragh, The Solar Element: A Reconsideration of Helium’s Early History., 2009, Annals of Science, 66:2, s157-182.
- J. Norman Lockyer, The Growth of our Knowledge of Helium., Science Progress, 1896, Vol 5., s249
- W. Thomson, Presidential Address, British Association for the Advancement of Science, 1871, (Address. XCIX).
- Sir Norman Lockyer, The Sun’s Place in Nature.., 1897, p47-48
Citer denne side
For online linking, please copy and paste one of the following:
<a href="https://www.chemicool.com/elements/helium.html">Helium</a>
or
<a href="https://www.chemicool.com/elements/helium.html">Helium Element Facts</a>
For at citere denne side i et akademisk dokument, please use the following MLA compliant citation:
"Helium." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/helium.html>.