Tegnene luminescens, fotoluminescens, fluorescens og fosforescens bruges rutinemæssigt i forskningsartikler til at beskrive emissionen af lys fra en prøve. Denne mangfoldige navngivning kan være forvirrende, idet flere af udtrykkene anvendes i flæng, og forskere med forskellig videnskabelig baggrund foretrækker at bruge det ene navn frem for det andet. I denne artikel besvarer vi spørgsmålet: “Hvad er forskellen på luminescens, fotoluminescens, fluorescens og fosforescens?”
Hvad er luminescens?
Luminescens er enhver emission af lys (elektromagnetiske bølger) fra et stof, som ikke opstår ved opvarmning. Denne definition adskiller luminescens fra glødning, som er lysemission som følge af et stofs forhøjede temperatur, f.eks. en glødende varm glød. Ordet luminescens er afledt af det latinske ord for lys, lumen, og det latinske ord escentia, der betyder “processen med”, og er således processen med at afgive lys.

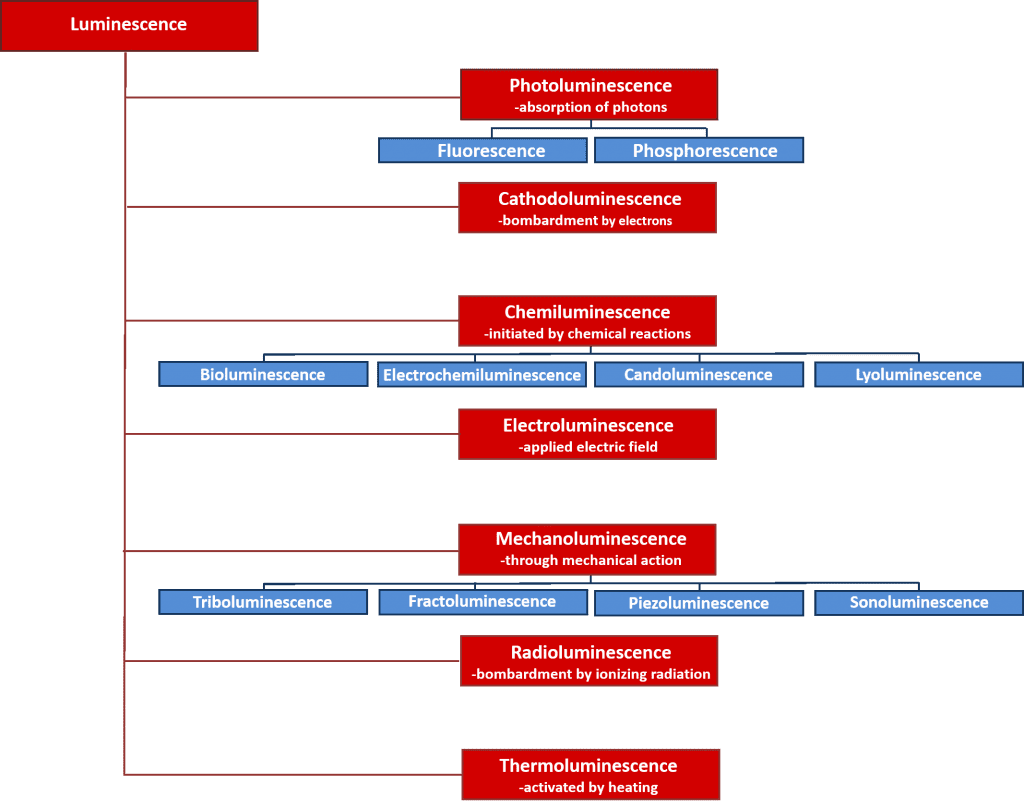
Der findes mange typer af luminescens, som kan klassificeres efter den energikilde, der sætter gang i luminescensprocessen. En oversigt over de forskellige typer luminescens og deres energikilder er vist i figur 2. Mange af disse luminescensprocesser har vigtige videnskabelige og industrielle anvendelser, f.eks. elektroluminescens, hvor lys udsendes ved rekombination af elektroner og huller efter påføring af et elektrisk felt på tværs af et materiale, og som er driftsprincippet bag lysemitterende dioder, og kemiluminescens, hvor lysemissionen initieres af en kemisk reaktion og anvendes i biologiske analyser og er ansvarlig for glødelampernes glødepinde. Denne artikel fokuserer imidlertid på fotoluminescens, som danner grundlaget for den effektive ikke-destruktive spektroskopiske teknik, fotoluminescensspektroskopi, der anvendes i vid udstrækning i både den akademiske verden og industrien.
Hvad er fotoluminescens?
Photoluminescens er emissionen af lys fra et materiale efter absorption af lys. Ordet i sig selv er interessant, idet det er en kombination af det latinske afledte ord luminescens og det græske præfiks, photo-, for lys. Enhver luminescens, der fremkaldes ved absorption af fotoner, kaldes fotoluminescens. Det kunne lige så godt være lysemission fra et organisk farvestofmolekyle i opløsning (figur 3a) eller bånd-til-bånd-rekombination af elektroner og huller efter fotoeksponering af en halvleder (figur 3b).

Det er korrekt at beskrive enhver fotonabsorptionsinduceret lysemission som fotoluminescens; det er dog almindelig praksis, især blandt kemikere, at underopdele fotoluminescens yderligere i fluorescens og fosforescens.
Hvad er forskellen på fluorescens og fosforescens?
Der findes forskellige definitioner af fluorescens og fosforescens, hvor den enkleste er, at fluorescens er umiddelbar fotoluminescens, der opstår meget kort tid efter fotoeksponering af et stof, mens fosforescens er langlivet fotoluminescens, der fortsætter længe efter, at fotoeksponeringen er ophørt. Selv om dette er en enkel definition, forklarer den ikke, hvorfor der er en sådan forskel i fotoluminiscensens tidsskalaer, og nogle materialer kan falde i en gråzone mellem de klassiske fluorescens- og fosforescenstidsskalaer. En mere grundig definition må baseres på kvantemekanikken for de exciterede og grundtilstande, der er involveret i emissionsprocessen. Ved hjælp af denne tilgang kan fluorescens og fosforescens defineres som henholdsvis fotoluminescens, hvor den strålende overgang ikke kræver en ændring i spinmultiplicitet, og fotoluminescens, hvor den strålende overgang indebærer en ændring i spinmultiplicitet.
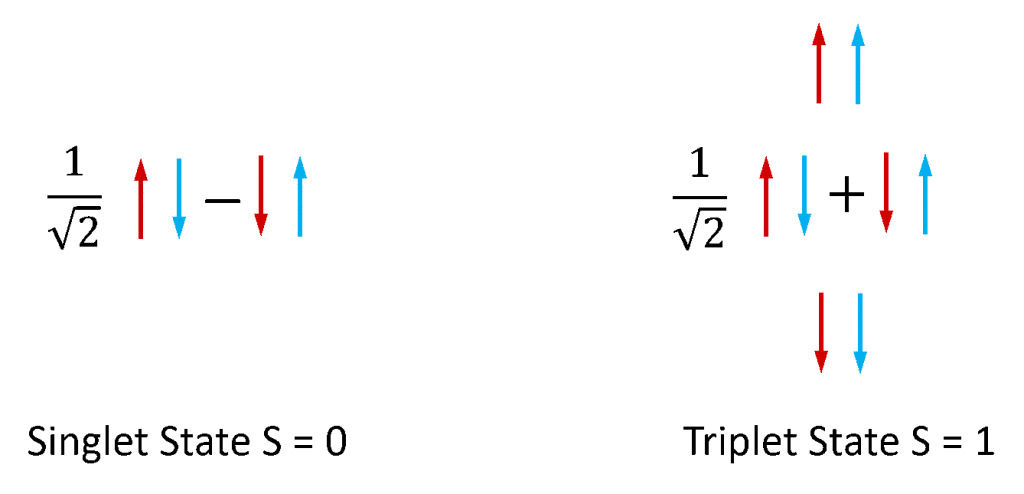
Fluorescens og fosforescens anvendes oftest til at betegne fotoluminescens fra molekylære systemer. Elektroner i stabile molekyler findes altid parvis, da molekyler med uparrede elektroner er ekstremt reaktive og ustabile. Elektroner har et iboende vinkelmoment, der er kendt som “spin”, og et elektronpar kan eksistere i en af to samlede spintilstande, afhængigt af den relative symmetri af de to elektroners spins. Hvis de to spins er i en antisymmetrisk konfiguration, har elektronparret et samlet spin på nul (S = 0), mens hvis de er i en symmetrisk konfiguration, har parret et samlet spin på et (S = 1). Som illustreret i figur 4 findes der én kombination af elektronspinpartilstande, der er antisymmetrisk, og tre kombinationer af spinpartilstande, der er symmetriske, og S = 0- og S = 1-tilstandene kaldes derfor henholdsvis singlet- og triplettilstandene.
Når en foton absorberes af molekylet, promoveres en af elektronerne til et højere energiniveau, og molekylet befinder sig nu i en exciteret tilstand. Et molekyls grundtilstand er (næsten) altid en singlettilstand (S0), og på grund af bevarelse af impulsmomentet må den fotoeksponerede tilstand også være en singlettilstand (S1), som vist i Jablonski-diagrammet nedenfor. Henfaldet af S1-tilstanden tilbage til S0-tilstanden er en tilladt overgang (da begge tilstande har samme spinmultiplicitet), hvilket resulterer i hurtig fotoluminescens, der opstår i tidsskalaen fra picosekunder til nanosekunder og kaldes fluorescens.
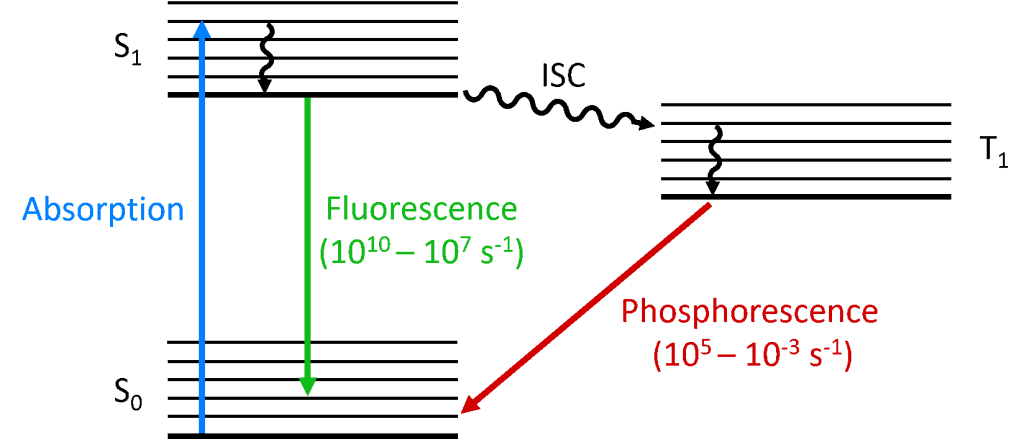
Alternativt kan molekylet gennemgå intersystem crossing (ISC) til den exciterede triplettilstand (T1). ISC forekommer typisk i molekyler med en høj grad af spin-orbit-kobling, koblingen af orbitalvinkelmomentet og elektronens spinvinkelmoment, hvilket muliggør konvertering mellem singlet- og triplettilstandene. Spin-orbit-koblingens styrke stiger med atomets masse, og fosforescerende molekyler skal derfor indeholde tungmetaller som europium og iridium. Henfaldet af T1-tilstanden tilbage til S0-tilstanden er en forbudt overgang, da tilstandene har forskellig spinmultiplicitet på grund af bevarelse af vinkelimpuls. Spin-orbit-kobling ophæver imidlertid denne begrænsning, og en strålingsovergang fra T1 til S1 bliver mulig. Da den er “forbudt”, forekommer den fotoluminescens, der er resultatet af T1- til S0-overgangen, på en meget langsommere tidsskala, mikrosekunder til tusindvis af sekunder, og kaldes fosforescens.
Det skal også bemærkes, at emissionen fra nogle materialer ikke altid falder pænt ind i den ene eller den anden kategori. Et eksempel herpå er termisk aktiveret forsinket fluorescens (TADF). I TADF er S1- og T1-niveauerne tæt på hinanden i energi og stærkt koblet, og omvendt ISC fra T1 til S1 er derfor mulig. Dette giver anledning til en forsinket S1- til S0-overgang, som resulterer i fotoluminescens på en tidsskala mellem fluorescens og fosforescens, kendt som forsinket fluorescens. For yderligere oplysninger om TADF og dens anvendelse i højeffektive OLED’er, læs indlægget “Hvad er TADF?”.
Hvornår emissionen skal beskrives som fotoluminescens versus fluorescens/fosforescens er i sidste ende en personlig præference. Kemikere og biologer, der primært studerer molekylære systemer, foretrækker brugen af fluorescens og fosforescens, da der i disse stærkt lokaliserede molekylære systemer er forskellige singlet- og triplettilstande. I modsætning hertil studerer fysikere overvejende halvledende materialer, hvor elektronerne er meget delokaliserede, og hvor begrebet singlet- og triplettilstand ofte ikke længere er relevant. Dette er en af grundene til, at fysikere har en tendens til at bruge det bredere begreb fotoluminescens til at beskrive lysemission.
Uanset hvad man vælger at kalde det, kan fotoluminescens, fluorescens og fosforescens give et væld af oplysninger om molekylers og materialers egenskaber, lige fra bestemmelse af ladningsbærernes levetid i solceller til måling af solvensdynamikken omkring miceller i levende celler.
Produkter til luminescens, fotoluminescens, fluorescens og fosforescens
For at måle fotoluminescens kræves et fotoluminescensspektrometer, og Edinburgh Instruments tilbyder en række fotoluminescensspektrometre med enkelt fotonoptælling til at måle fotoluminescensspektrer, levetider, anisotropi og kvanteudbytte af dine prøver.
Hold kontakten
Hvis du har nydt at læse denne artikel og gerne vil være den første til at se alle de seneste nyheder, applikationer og produktinformationer fra Edinburgh Instruments, så tilmeld dig vores uregelmæssige nyhedsbrev via den røde tilmeldingsknap nedenfor, og følg os på de sociale medier.