Nogle atomer er mere polære end andre, fordi de er mere “grådige” efter elektroner.
Se på dit periodiske system, jo mere til højre og opad du går, jo mere elektronegative bliver atomerne (ædelgasserne er ikke medregnet, fordi de har fulde skaller og er “glade” og ikke har brug for valenselektroner).
Jeg tror, at alle har hørt, at flourin (F) f.eks. er et af de mest elektronegative grundstoffer, det vil bogstaveligt talt rive elektroner fra hydrogenatomer eller kulstofatomer. Det samme vil klor (Cl)
Tjek dette billede:
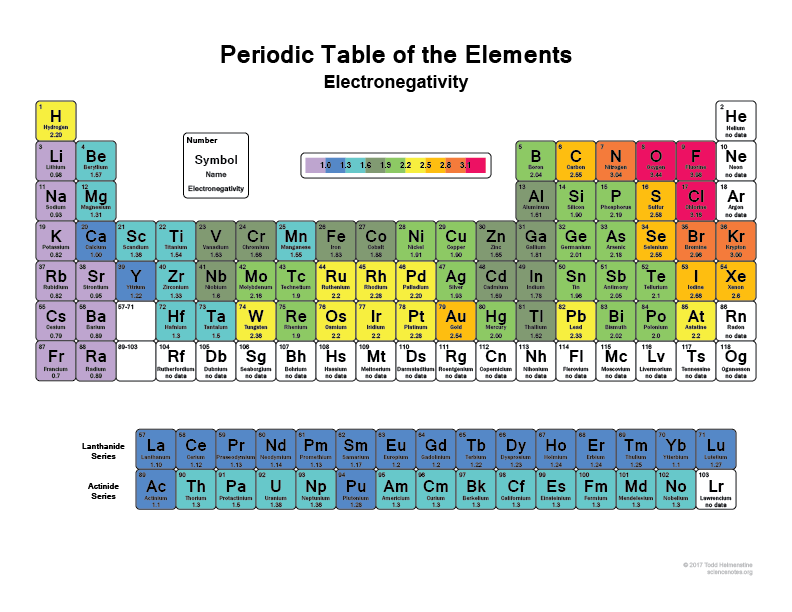
Det er derfor, når en binding nogle molekyler har superpolære områder, fordi de har noget som hydrogen, der binder sig med noget som flourin, der stort set bare har elektronerne med sig det meste af tiden.
Dette spørgsmål kan også forklares med ideen om elektronskyer og det faktum, at mere elektronegative atomer normalt vil have flere elektroner, der opholder sig med det meste af tiden i forhold til ikke så meget elektronegative atomer.

Dette kaldes dipolmomentet, og uden at komme for meget ind på det kan man se, hvordan de fleste elektroner er tættere på ilten end på brinten (fordi ilten er mere elektronegativ end brinten)
I øvrigt lyder ordet elektronegativ nogle gange kontraintuitivt, men det er elektro-negativt i stedet for positivt, fordi i kemi har atomer, der får elektroner, et negativt fortegn (eks.: #Cl^-# er et klor, der har fået en elektron).