Generisk navn: natriumpolystyrensulfonat
Doseringsform: oral / rektal suspension
Medicinsk gennemgået af Drugs.com. Sidst opdateret den 22. juli 2020.
- Overblik
- Bivirkninger
- Dosering
- Professionel
- Interaktioner
- Mere
- Indikationer og anvendelse for Kionex
- Kionex Dosering og administration
- Allmene oplysninger
- Anbefalet dosering
- Forberedelse og administration
- Doseringsformer og styrker
- Kontraindikationer
- Varsler og forsigtighedsregler
- Intinal nekrose
- Elektrolytforstyrrelser
- Fluidoverbelastning hos patienter, der er følsomme over for højt natriumindtag
- Risiko for aspiration
- Binding til andre oralt indgivne lægemidler
- Bivirkninger
- Lægemiddelinteraktioner
- Generelle interaktioner
- Kationedonerende antacida
- Sorbitol
- Brug hos særlige befolkningsgrupper
- Graviditet
- Atmning
- Pædiatrisk brug
- Overdosering
- Kionex Beskrivelse
- Kionex – Klinisk farmakologi
- Virkningsmekanisme
- Farmakodynamik
- Farmakokinetik
- Nonklinisk toksikologi
- Carcinogenese, mutagenese, forringelse af fertiliteten
- Hvordan leveres/opbevaring og håndtering
- Patientrådgivning
- PAKNING/ETIKAT PRINCIPAL DISPLAY PANEL
- Mere om Kionex (natriumpolystyrensulfonat)
- Forbrugerressourcer
- Faglige ressourcer
- Relaterede behandlingsvejledninger
Indikationer og anvendelse for Kionex
Kionexis er indiceret til behandling af hyperkaliæmi.
Begrænsning af anvendelse:
Kionex bør ikke anvendes som nødbehandling af livstruende hyperkaliæmi på grund af dets forsinkede virkningstidspunkt .
Kionex Dosering og administration
Allmene oplysninger
Administrer Kionex mindst 3 timer før eller 3 timer efter anden oral medicinering. Patienter med gastroparese kan kræve en 6 timers adskillelse
Anbefalet dosering
Intensiteten og varigheden af behandlingen afhænger af sværhedsgraden og modstanden af hyperkaliæmi.
Oral
Den gennemsnitlige samlede daglige voksendosis af Kionex er 15 g til 60 g, administreret som en 15 g-dosis (fire lige store teskefulde), en til fire gange dagligt.
Rektalt
Den gennemsnitlige voksendosis er 30 g til 50 g hver sjette time.
Forberedelse og administration
Forbered suspensionen frisk og brug inden for 24 timer.
Kionex må ikke opvarmes, da det kan ændre harpiksens udvekslingsegenskaber.
En jævn teskefuld indeholder ca. 3,5 g Kionex og 15 mEq natrium.
Oral Suspension
Suspender hver dosis i en lille mængde vand eller sirup, ca. 3 til 4 ml væske pr. gram harpiks. Administreres med patienten i oprejst stilling.
Enema
Efter et indledende rensende lavement indføres en blød gummislange af stor størrelse (fransk 28) i rektum i en afstand af ca. 20 cm med spidsen godt inde i colon sigmoideum og tape på plads.
Administreres som en varm (kropstemperatur) emulsion i 100 mL vandigt medium og skylles med 50 til 100 ml væske. Der kan anvendes en noget tykkere suspension, men der må ikke dannes en pasta.
Agiter emulsionen forsigtigt under administrationen. Harpiksen bør holdes tilbage så længe som muligt og følges op af et rensende lavement med en ikke-natriumholdig opløsning. Sørg for, at der anvendes en tilstrækkelig mængde renseopløsning (op til 2 liter).
Doseringsformer og styrker
Kionex er et cremefarvet til lysebrunt, fintmalet pulver og fås i 454 g krukker.
Kontraindikationer
Kionex er kontraindiceret hos patienter med følgende tilstande:
– Overfølsomhed over for polystyrensulfonatharpikser – Obstruktiv tarmsygdom – Neonater med nedsat tarmmotilitet
Varsler og forsigtighedsregler
Intinal nekrose
Fælde af tarmnekrose, nogle med dødelig udgang, og andre alvorlige gastrointestinale bivirkninger (blødning, iskæmisk colitis, perforation) er blevet rapporteret i forbindelse med brug af Kionex. De fleste af disse tilfælde rapporterede om samtidig brug af sorbitol. Risikofaktorer for gastrointestinale bivirkninger var til stede i mange af tilfældene, herunder præmaturitet, tarmsygdom eller -kirurgi i fortiden, hypovolæmi og nyreinsufficiens og nyresvigt. Samtidig indgift af sorbitol anbefales ikke.
– Må kun anvendes til patienter, der har normal tarmfunktion. Undgå brug hos patienter, der ikke har haft afføring efter en operation. – Undgå brug hos patienter, der er i risiko for at udvikle forstoppelse eller impaktion (herunder patienter med anamnese for impaktion, kronisk forstoppelse, inflammatorisk tarmsygdom, iskæmisk colitis, vaskulær intestinal aterosklerose, tidligere tarmresektion eller tarmobstruktion). Afbryd brugen hos patienter, der udvikler forstoppelse.
Elektrolytforstyrrelser
Kontroller serumkalium under behandlingen, da der kan forekomme alvorlig hypokaliæmi.
Kionex er ikke helt selektivt for kalium, og små mængder af andre kationer såsom magnesium og calcium kan også gå tabt under behandlingen. Overvåg calcium og magnesium hos patienter, der modtager Kionex.
Fluidoverbelastning hos patienter, der er følsomme over for højt natriumindtag
På hver 15 g dosis Kionex er der 1500 mg (60 mEq) natrium. Overvåg patienter, der er følsomme over for natriumindtag (hjertesvigt, hypertension, ødem) for tegn på væskeoverbelastning. Justering af andre natriumkilder kan være nødvendig.
Risiko for aspiration
Fælde af akut bronkitis eller bronchopneumoni forårsaget af inhalation af natriumpolystyrensulfonatpartikler er blevet rapporteret. Patienter med nedsat gag-refleks, ændret bevidsthedsniveau eller patienter med tendens til regurgitation kan være i øget risiko. Administrer Kionex med patienten i oprejst stilling.
Binding til andre oralt indgivne lægemidler
Kionex kan binde oralt indgivne lægemidler, hvilket kan nedsætte deres gastrointestinale absorption og føre til nedsat effekt. Indgiv anden oral medicin mindst 3 timer før eller 3 timer efter Kionex. Patienter med gastroparese kan kræve en 6 timers adskillelse. .
Bivirkninger
Følgende bivirkninger er omtalt andetsteds i mærkningen:
– Intestinal nekrose – Elektrolytforstyrrelser – Aspiration
Følgende bivirkninger er blevet identificeret under anvendelse af Kionex efter godkendelsen. Da disse reaktioner er rapporteret frivilligt fra en population af usikker størrelse, er det ikke altid muligt at vurdere deres hyppighed pålideligt eller at fastslå en årsagssammenhæng med lægemiddeleksponeringen.
Gastrointestinal: anoreksi, forstoppelse, diarré, afføringsbylder, gastrointestinale konkretioner (bezoarer), iskæmisk colitis, kvalme, ulcerationer, opkastning, maveirritation, tarmobstruktion (på grund af koncentrationen af aluminiumhydroxid)
Metabolsk: systemisk alkalose
Lægemiddelinteraktioner
Generelle interaktioner
Ingen formelle undersøgelser af lægemiddelinteraktioner er udført på mennesker.
Kionex har potentiale til at binde andre lægemidler. I in vitro bindingsundersøgelser blev det vist, at Kionex binder signifikant de orale lægemidler (n=6), der blev testet. Der er også rapporteret nedsat absorption af lithium og thyroxin ved samtidig indtagelse af Kionex. Binding af Kionex til andre orale lægemidler kan medføre nedsat gastrointestinal absorption og tab af effekt, når det tages tæt på det tidspunkt, hvor Kionex administreres. Indgiv Kionex mindst 3 timer før eller 3 timer efter anden oral medicinering. Patienter med gastroparese kan kræve en 6 timers adskillelse. Overvåg for klinisk respons og/eller blodniveauer, hvor det er muligt.
Kationedonerende antacida
Den samtidige orale indgivelse af Kionex med ikkeabsorberbare kationedonerende antacida og laksantia kan reducere harpiksens kaliumudvekslingsevne og øge risikoen for systemisk alkalose.
Sorbitol
Sorbitol kan bidrage til risikoen for tarmnekrose, og samtidig brug anbefales ikke.
Brug hos særlige befolkningsgrupper
Graviditet
Risikoresumé
Kionex absorberes ikke systemisk efter oral eller rektal administration, og brug hos moderen forventes ikke at resultere i fosterrisiko.
Atmning
Risikoresumé
Kionex absorberes ikke systemisk af moderen, så amning forventes ikke at medføre risiko for spædbarnet.
Pædiatrisk brug
Der er ikke foretaget undersøgelser af sikkerhed og effekt hos pædiatriske patienter.
I pædiatriske patienter forventes Kionex, som hos voksne, at binde kalium med det praktiske udvekslingsforhold på 1mEq kalium pr. 1 gram harpiks.
I neonater bør Kionex ikke gives ad oral vej. Hos både børn og nyfødte kan overdreven dosering eller utilstrækkelig fortynding resultere i impaktion af harpiksen. For tidligt fødte børn eller børn med lav fødselsvægt kan have en øget risiko for gastrointestinale bivirkninger med Kionex. brug .
Overdosering
Overdosering kan resultere i elektrolytforstyrrelser, herunder hypokaliæmi, hypokalcæmi og hypomagnesiæmi. Der bør træffes passende foranstaltninger for at korrigere serumelektrolytterne (kalium, calcium, magnesium), og harpiksen bør fjernes fra fordøjelseskanalen ved passende brug af laksantia eller lavementer.
Kionex Beskrivelse
Kionex er et benzen, diethenyl-polymer, med ethenylbenzen, sulfoneret, natriumsalt og har følgende strukturformel:
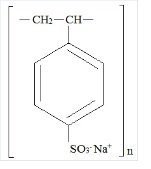
Lægemidlet er en creme til lysebrun, fint formalet, pulveriseret form af natriumpolystyrensulfonat, en kationbytterharpiks fremstillet i natriumfasen med en in vitro byttekapacitet på ca. 3.1 mEq (in vivo ca. 1 mEq) kalium pr. gram. Natriumindholdet er ca. 100 mg (4,1 mEq) pr. gram af lægemidlet. Det kan administreres oralt eller rektalt som et lavement.
Et gram Kionex indeholder 4,1 mEq natrium.
Kionex – Klinisk farmakologi
Virkningsmekanisme
Kionex er en ikke-absorberet, kationbyttende polymer, der indeholder et natrium modion.
Kionex øger den fækale kaliumudskillelse gennem binding af kalium i lumen i mave-tarmkanalen. Binding af kalium reducerer koncentrationen af frit kalium i det gastrointestinale lumen, hvilket resulterer i en reduktion af kaliumniveauet i serum. Det praktiske udvekslingsforhold er 1 mEq K pr. 1 gram harpiks.
Når harpiksen passerer langs tarmen eller bliver tilbageholdt i colon efter indgift ved lavement, frigøres natriumionerne delvist og erstattes af kaliumioner. Denne virkning sker primært i tyktarmen, som udskiller kaliumioner i større grad end tyndtarmen. Effektiviteten af denne proces er begrænset og uforudsigeligt variabel.
Farmakodynamik
Den effektive sænkning af serumkalium med Kionex kan tage timer til dage.
Farmakokinetik
In vivo er effektiviteten af natrium-kalium-udvekslingsharpikser ca. 33 procent; således afgives ca. en tredjedel af harpiksens faktiske natriumindhold til kroppen.
Kionex absorberes ikke systemisk.
Lægemiddelinteraktioner
In vitro bindingsundersøgelser viste, at Kionex bundet signifikant til følgende testede lægemidler – warfarin, metoprolol, phenytoin, furosemid, amlodipin og amoxicillin.
Nonklinisk toksikologi
Carcinogenese, mutagenese, forringelse af fertiliteten
Der er ikke udført undersøgelser.
Hvordan leveres/opbevaring og håndtering
Kionex fås som et cremefarvet til lysebrunt, fintmalet pulver i krukker med 1 pund (454 g), NDC 0574-2004-16.
Opbevares ved 20° til 25°C (68° til 77°F) .
Patientrådgivning
Medicinsk interaktion
Rådgiv patienter, der tager anden oral medicin, at de skal adskille doseringen af Kionex med mindst 3 timer (før eller efter)
Rx Only
Pakket af
Perrigo
Minneapolis, MN 55427
Revideret 08/2017
PAKNING/ETIKAT PRINCIPAL DISPLAY PANEL
Kun receptpligtig
NDC 0574-2004-16
Kionex®
Natriumpolystyrensulfonat til suspension
MIDDELVoksendosis: 15 g (ca. 4 jævne teskefulde) en til fire gange dagligt i vand. Se den fuldstændige indlægsseddel.
Virkningen skal kontrolleres omhyggeligt ved hyppige serumkaliumbestemmelser inden for hver 24-timers periode. Natriumindhold ca. 60 mEq pr. 15 g.
Suspensionen skal være frisk tilberedt og må ikke opbevares længere end 24 timer. Afleveres i tætte, lysafvisende beholdere som defineret i USP.
LAGERING: Opbevares ved 20° til 25°C (68° til 77°F) .
Læs indlægsseddel.
454 gram (1 LB)
| Kionex natriumpolystyrensulfonatpulver, til suspension |
|||||||||||||||||||||
|
|||||||||||||||||||||
|
|||||||||||||||||||||
|
|||||||||||||||||||||
| Pakning | |||
| # | Artikelkode | Pakkebeskrivelse | |
| 1 | NDC:0574-2004-16 | 454 g i 1 FLASKE, PLASTIK | |
| Markedsføringsoplysninger | |||
| Markedsføringsgruppe | Anvendelsesnummer eller henvisning til monografi | Startdato for markedsføring | Slutdato for markedsføring |
| ANDA | ANDA040029 | 01/02/1998 | 31/07/2018 |
Mærkningssted – Paddock Laboratories, LLC (967694121)
Mere om Kionex (natriumpolystyrensulfonat)
- Bivirkninger
- Under graviditet eller amning
- Doseringsinformation
- Medikamentinteraktioner
- En Español
- 4 anmeldelser
- Lægemiddelklasse: kationbytterharpikser
- FDA-advarsler (2)
Forbrugerressourcer
- Patientinformation
- Kionex (Avanceret læsning)
Faglige ressourcer
- Oplysningsinformation
- Natriumpolystyrensulfonat oral pulver (FDA)
Andre mærker Kayexalat, Kalexate
Relaterede behandlingsvejledninger
- Hyperkaliæmi
Medicinsk ansvarsfraskrivelse