
Brønsted i sit laboratorium
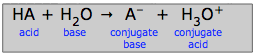
I henhold til Brønsted-Lowry-konceptet betragtes den proces, der tidligere blev skrevet som en simpel dissociation af en generisk syre HA (HA → H+ + A-), mere korrekt som en protonoverførselsproces:
HA + H2O → A-+ H3O+(3-1)
Tanken er igen, at protonen, når den forlader syren, skal ende med at være bundet til noget (som vi kalder en base;) den kan ikke bare flyde rundt som en fri brint-ion.
- Konjugerede syre-basepar
- Stærke syrer og svage syrer
- Definition af en “stærk” syre
- Den nivellerende effekt
- svage syrer
- Stærke syrer har svage konjugerede baser
- Salte af svage syrer opløses til alkaliske opløsninger
- De eneste almindelige stærke baser er gruppe 1-hydroxider
- Salte af svage baser giver sure opløsninger
- Autoprotolyse
- Ampholytter
- Carbonatsyre-basesystemet
Konjugerede syre-basepar
En reaktion af en syre med en base er således en protonudvekslingsreaktion; hvis syren betegnes med AH og basen med B, kan vi skrive en generaliseret syre-base-reaktion som
AH + B → A- + BH+(3-2)
Bemærk, at det omvendte af denne reaktion,
BH+ + A- → B + AH(3-3)
også er en syre-base-reaktion. Da protonoverførselsreaktioner er reversible, følger det, at overførsel af en proton fra en syre til en base nødvendigvis må skabe et nyt par af arter, der i det mindste i princippet selv kan udgøre et syre-basepar, som vi betegner som et konjugeret syre-basepar:
Tegnet konjugeret betyder “forbundet med”, hvilket indebærer, at medlemmerne af et konjugeret par er “forbundet” ved tilstedeværelsen eller fraværet af en proton.
Hvilke arter der betragtes som “konjugerede” afhænger af den retning, som reaktionen er skrevet i, som vist nedenfor for protonoverførslen i (3-1):


Sådan har vi for de generaliserede protonoverførsler (3-2) og (3-3)


Tabellen nedenfor viser de konjugerede par i en række typiske syre-base-systemer.
| syre | base | |||
| hydrochlorsyre | HCl | chlorid-ion | Cl- | |
| eddikesyre | CH3CH2COOH | acetation | CH3CH2COO- | |
| nitronsyre | HNO3 | nitrat-ion | NO3- | |
| dihydrogenphosphat-ion | H2PO4- | monohydrogenphosphat-ion | HPO42- | |
| hydrogensulfat-ion | HSO4- | sulfat-ion | SO42- | |
| hydrogensulfat-ion | carbonat (“bicarbonat”)-ion | HCO3- | carbonat-ion | CO32- |
| ammonium-ion | NH4+ | ammoniak | NH3 | |
| jern(III)-ion (“jern(III)-ion”) | Fe(H2O)63+ | pentaaquoironIII | Fe(H2O)5OH2+ | |
| vand | H2O | hydroxidion | OH- | |
| hydroniumion | H3O+ | vand | H2O | |
Stærke syrer og svage syrer
Vi kan se på den generaliserede syre-base-reaktion
som en konkurrence mellem to baser om en proton:

Definition af en “stærk” syre
Hvis basen H2O vinder dette tovtrækkeri med overvældende vægt, så siges syren HA at være en stærk syre. Dette er, hvad der sker med saltsyre og de andre almindelige stærke “mineralsyrer” H2SO4, HNO3 og HClO4:
Løsninger af disse syrer i vand er i virkeligheden opløsninger af de ioniske arter, der er vist med fed skrift til højre. Da dette er tilfældet, følger det, at det, som vi f.eks. kalder en 1 M opløsning af “saltsyre” i vand, i virkeligheden slet ikke indeholder en betydelig koncentration af HCl; den eneste virkelige syre, der er til stede i en sådan opløsning, er H3O+!
Disse overvejelser giver anledning til to vigtige regler, som du ikke blot skal kende, men også forstå:
H3O+ er den stærkeste syre, der kan eksistere i vand;
Alle stærke syrer synes at være lige stærke i vand.
Den nivellerende effekt
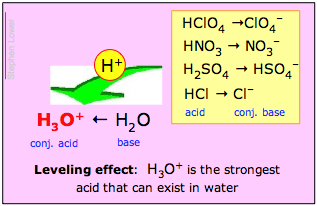
Den anden af disse udsagn kaldes den nivellerende effekt. Det betyder, at selv om de stærke syrers iboende proton-donorstyrker er forskellige, er de alle fuldstændig dissocierede i vand. Kemikere siger, at deres styrker “nivelleres” af opløsningsmidlet vand.
En tilsvarende effekt ville man se, hvis man forsøgte at bedømme flere voksnes styrker ved at gennemføre en række tovtrækkerkonkurrencer med et lille barn. Man ville forvente, at de voksne ville vinde med overvældende flertal i hver enkelt forsøg; deres styrke ville være blevet “udjævnet” af barnets styrke.
svage syrer
De fleste syrer er imidlertid i stand til at holde fast i deres protoner mere fast, så kun en lille brøkdel af syren dissocieres. Cyanhydronsyre, HCN, er således en svag syre i vand, fordi protonerne er i stand til at dele cyanidionens CN-‘s lone pair-elektroner mere effektivt end de kan med H2O’s, så reaktionen
HCN + H2O → H3O+ + CN-
fortsætter kun i meget lille omfang.
Da en stærk syre kun binder sin proton svagt, mens en svag syre binder den tæt, kan vi sige, at
Stærke syrer er “svage”; svage syrer er “stærke”
Hvis du er i stand til at forklare dette tilsyneladende paradoks, forstår du en af de vigtigste ideer i syre-base-kemi!
|
reaktion
|
syre
|
base
|
konjugat syre
|
konjugat base
|
konjugat base
|
| 1) autoionisering af vand H2O | H2O | H2O | H3O+ | OH- | |
| 2) ionisering af cyanvandsyre HCN | HCN | H2O | H3O+ | CN- | |
| 3) ionisering af ammoniak NH3 i vand | NH3 | H2O | NH4+ | OH- | |
| 4) hydrolyse af ammoniumchlorid NH4Cl | NH4+ | H2O | H3O+ | NH3 | |
| 5) hydrolyse af natriumacetat CH3COO- Na+ | H2O | CH3COOO- | CH3COOH | OH- | |
| 6) Neutralisering af HCl med NaOH | HCl | OH- | H2O | Cl- | |
| 7) neutralisering af NH3 med eddikesyre | CH3COOH | NH3 | NH4+ | CH3COO- | |
| 8) Opløsning af BiOCl (bismuthoxychlorid) med HCl | 2 H3O+ | BiOCl | Bi(H2O)3+ | H2O, Cl- | |
| 9) nedbrydning af Ag(NH3)2+ ved HNO3 | 2 H3O+ | Ag(NH3)2+ | NH4+ | H2O | |
| 10) fortrængning af HCN ved CH3COOH | CH3COOH | CN- | HCN | CH3COO- |
Stærke syrer har svage konjugerede baser
Det er blot en re-redegørelse for det, der ligger implicit i det, der er blevet sagt ovenfor om forskellen mellem stærke syrer og svage syrer. Det faktum, at HCl er en stærk syre, indebærer, at dens konjugerede base Cl- er en for svag base til at holde på protonerne i konkurrence med enten H2O eller H3O+. På samme måde binder CN- ionen stærkt til en proton, hvilket gør HCN til en svag syre.
Salte af svage syrer opløses til alkaliske opløsninger
Den omstændighed, at HCN er en svag syre, indebærer, at cyanidionen CN- reagerer let med protoner, og er dermed er en relativt god base. Som bevis herpå giver et salt som KCN, når det opløses i vand, en svagt basisk opløsning:
CN- + H2O → HCN + OH-
Denne reaktion omtales stadig nogle gange under sit gamle navn hydrolyse (“vandspaltning”), hvilket er bogstaveligt korrekt, men har en tendens til at sløre dens identitet som blot endnu en syre-base-reaktion. Reaktioner af denne type finder kun sted i ringe omfang; en 0,1M opløsning af KCN er stadig, for alle praktiske formål, 0,1M i cyanidion.
De eneste almindelige stærke baser er gruppe 1-hydroxider
Den eneste virkelig stærke base, du sandsynligvis vil støde på i daglig kemi, er alkalimetallhydroxider som NaOH og KOH, som i det væsentlige er opløsninger af hydroxidionen (og naturligvis af kationen.)
De fleste andre forbindelser, der indeholder hydroxidioner, såsom Fe(OH)3 og Ca(OH)2, er ikke tilstrækkeligt opløselige i vand til at give stærkt alkaliske opløsninger, så de betragtes normalt ikke som stærke baser.
Der findes faktisk en række baser, der er stærkere end hydroxidionen – bedst kendt er oxidionen O2- og amidionen NH2-, men disse er så stærke, at de endda kan berøve vand en proton:
O2- + H2O → 2 OH-
NH2- + H2O → NH3 + OH-
Dette giver anledning til den samme form for udjævningseffekt, som vi beskrev for syrer, med den konsekvens, at
Salte af svage baser giver sure opløsninger
Det mest almindelige eksempel på dette er ammoniumchlorid, NH4Cl, hvis vandige opløsninger er tydeligt sure:
NH4+ + H2O → NH3 + H3O+
Da denne (og lignende) reaktion kun finder sted i ringe omfang, vil en opløsning af ammoniumchlorid kun være svagt sur.
Autoprotolyse
Fra nogle af de ovenfor nævnte eksempler, ser vi, at vand kan fungere som syre
CN- + H2O → HCN + OH-
og som base
NH4+ + H2O → NH3 + H3O+
Hvis dette er tilfældet, er der ingen grund til, at “vand-syren” ikke kan afgive en proton til “vand-basen”:

Denne reaktion er kendt som autoprotolyse af vand.
Kemikere omtaler stadig ofte denne reaktion som “dissociation” af vand og bruger den Arrhenius-agtige ligning H2O → H+ + OH- som en slags stenografi.
Som omtalt i den foregående lektion forekommer denne proces kun i et meget lille omfang. Det betyder dog, at både hydronium- og hydroxidioner er til stede i enhver vandig opløsning.
Kan andre væsker udvise autoprotolyse? Svaret er ja. Det mest kendte eksempel er flydende ammoniak:
2 NH3 → NH4+ + NH2-
Selv ren flydende svovlsyre kan spille med i spillet:
2 H2SO4→ H3SO4+ + HSO4-
Hver af disse opløsningsmidler kan danne grundlag for sit eget syre-base-“system”, parallelt med det velkendte “vandsystem”.
Ampholytter
Vand, der kan optræde som enten syre eller base, siges at være amfiprotisk: det kan “svinge begge veje”. Et stof som vand, der er amfiprotisk, kaldes en amfolyt.
Som det fremgår her, kan hydroxidionen også være en amfolyt, men ikke i vandig opløsning, hvori oxidionen ikke kan eksistere.
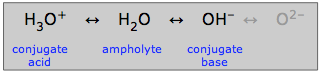
Det er naturligvis vandets amfiprotiske natur, der gør det muligt for det at spille sin særlige rolle i den almindelige akvatiske syre-base-kemi. Men mange andre amfiprotiske stoffer kan også eksistere i vandige solutoner. Ethvert sådant stof vil altid have en konjugeret syre og en konjugeret base, så hvis man kan genkende disse to konjugater af et stof, vil man vide, at det er amfiprotisk.
Carbonatsyre-basesystemet
For eksempel udgør tripletsættet {carbonsyre, bikarbonat-ion, carbonat-ion} en amfiprotisk serie, hvor bikarbonat-ionen er amfolyten, der adskiller sig fra en af sine naboer ved at tilføje eller fjerne en proton:
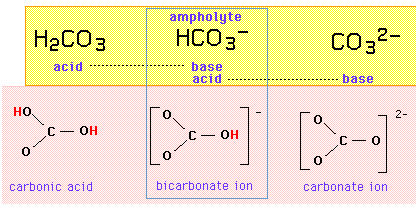
Hvis bikarbonat-ionen både er en syre og en base, bør den være i stand til at udveksle en proton med sig selv i en autoprotolysereaktion:
HCO3- + HCO3- → H2CO3 + CO32-
Dit liv afhænger af ovenstående reaktion! CO2, et metabolisk biprodukt fra hver eneste celle i din krop, reagerer med vand og danner kulsyre
H2CO3, som, hvis det fik lov til at ophobe sig, ville gøre dit blod dødeligt surt. Blodet indeholder imidlertid også carbonat-ioner, som reagerer i henhold til den omvendte af ovenstående ligning og danner bikarbonat, som blodet uden risiko kan transportere til lungerne. I lungerne kører autoprotolysereaktionen fremadrettet og producerer H2CO3, som mister vand og danner CO2, der udstødes med åndedrættet. Karbonat-ionen genanvendes tilbage i blodet for til sidst at opsamle endnu et CO2-molekyle.