Tabellerne og figurerne nedenfor viser, hvordan smeltepunktet ændrer sig med stigende kulstoftal op til C33 for forskellige typer kulbrinter, alkoholer og carboxylsyrer. Nærmere definitioner og eksempler på molekylstrukturer for de forskellige klasser af organiske forbindelser er angivet under figurerne.
- Smeltepunkt – den temperatur, ved hvilken et fast stof bliver til en væske
- Kogepunkt – den temperatur, ved hvilken en væske bliver til en gas
For kulbrinter med samme kulstoftal stiger kogepunktet i følgende rækkefølge:
multisubstitueret alkan < enkeltsubstitueret alkan < enkeltsubstitueret alken < normal alken < normal alkan < alkylcyclohexan < alkylbenzen < cycloalken < cycloalken < cycloalkan < 2-, 4- og 3-alkanol / 1-alkylnaphthalen < 1-alkanol < normal alkansyre
For smeltepunkterne er tendenserne mere varierende med stigende kulstofantal for de forskellige typer kulbrinter.
Se også kogepunkter for kulbrinter, alkoholer og syrer, densiteter for forskellige typer af organiske forbindelser og densitet, koge- og smeltepunkter for nitrogen- og svovlforbindelser.
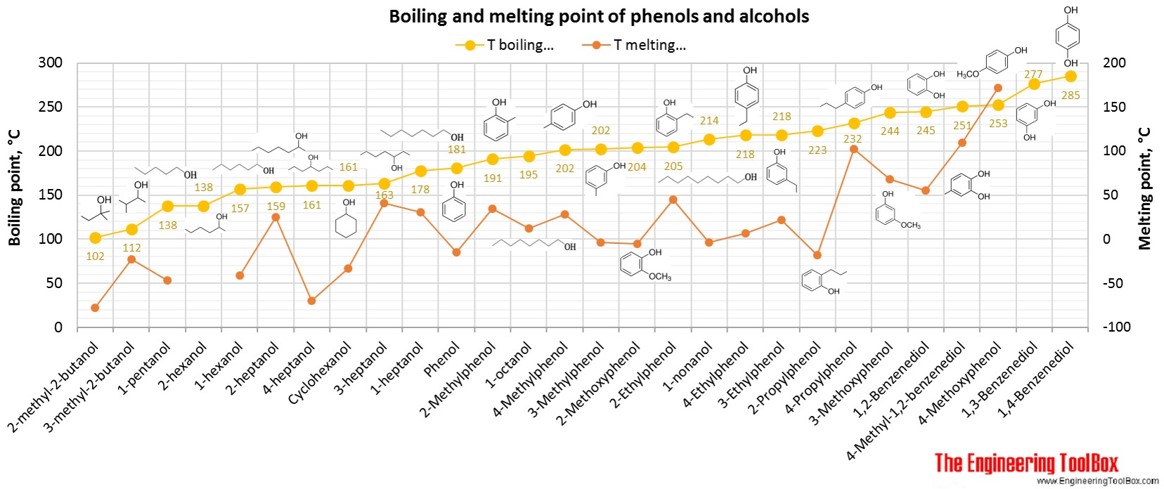
Se også pKa-værdier for phenoler, alkoholer og carboxylsyrer.
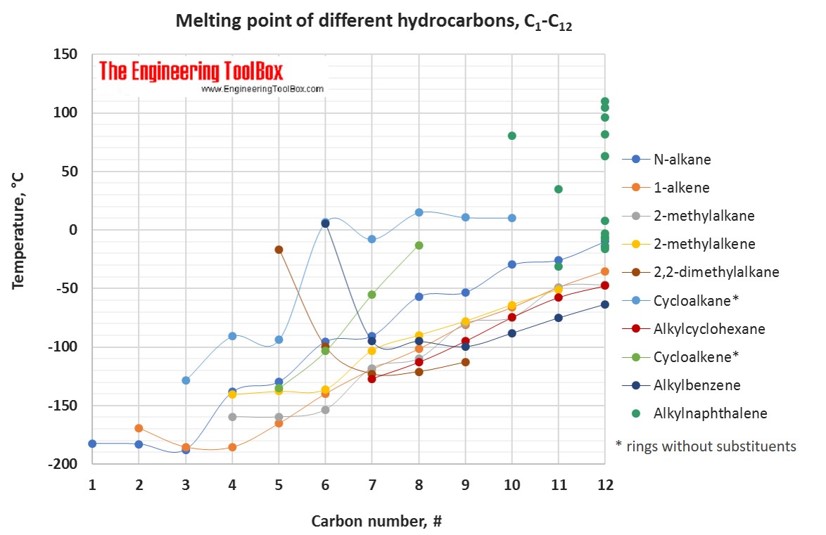
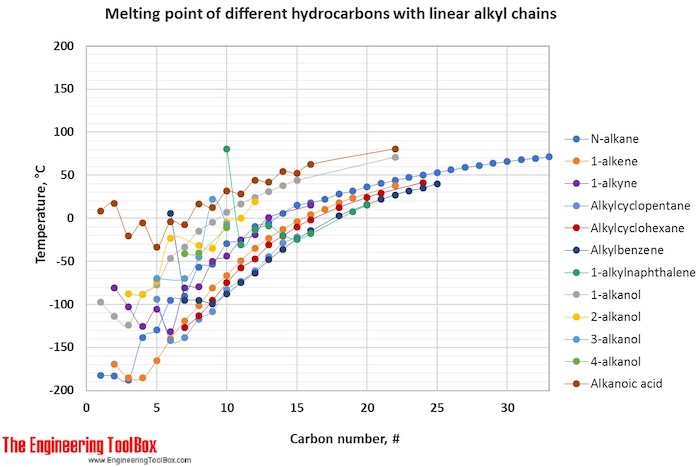
For fuld tabel – drej på skærmen!
| Smeltepunkt for carbonhydrider, alkoholer og syrer, C1-C16, angivet i °C | |||||||||||||||||||||
| Kulstofnummer | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | |||||
| Alkylcyclohexan* | -127 | -113 | -95 | -78 | -58 | -48 | -31 | -20 | -10 | -2 | |||||||||||
| 2,2-dimetylalkan | -17 | -100 | -123 | -123 | -121 | -113 | |||||||||||||||
| 3-methylalkan | -118 | -119 | -121 | -108 | -85 | -80 | -58 | ||||||||||||||
| Alkylbenzen* | 6 | -95 | -95 | -100 | -88 | -75 | -63 | -48 | -36 | -24 | -14 | ||||||||||
| Alkylcyclopentan | -142 | -138 | -117 | -108 | -83 | -73 | -61 | -45 | -29 | -22 | |||||||||||
| 2-methylalkan | -160 | -160 | -160 | -154 | -118 | -110 | -80 | -75 | -49 | -47 | |||||||||||
| 1-alken | -169 | -169 | -185 | -185 | -165 | -140 | -119 | -102 | -81 | -66 | -49 | -35 | -23 | -13 | -4 | ||||||
| 2-methylalken | -140 | -138 | -136 | -103 | -90 | -78 | -64 | -51 | |||||||||||||
| N-alkan | -183 | -183 | -188 | -138 | -130 | -95 | -91 | -57 | -53 | -30 | -26 | -10 | |||||||||
| 1-alkyne | -81 | -103 | -126 | -106 | -132 | -81 | -79 | -50 | -44 | -25 | -19 | 1 | 15 | ||||||||
| 3-alkanol | -70 | -70 | -45 | 22 | -8 | ||||||||||||||||
| Cycloalken** | -135 | -104 | -55 | ||||||||||||||||||
| 4-alkanol | -41 | -41 | -11 | ||||||||||||||||||
| 2-alkanol | -88 | -88 | -73 | -23 | -32 | -35 | -5 | 0 | 19 | ||||||||||||
| 1-alkanol | -98 | -114 | -124 | -89 | -78 | -46 | -33 | -15 | -5 | 7 | 17 | 24 | 31 | 38 | 44 | ||||||
| Cycloalkan** | -129 | -91 | -94 | 7 | -8 | 15 | 11 | 10 | |||||||||||||
| Alkansyre | 8 | 17 | -21 | -5 | -34 | -4 | -7 | 17 | 12 | 31 | 29 | 44 | 42 | 63 | |||||||
| 1-alkylnaphthalen | 80 | -31 | -14 | -9 | -20 | -25 | -18 | ||||||||||||||
| Smeltepunkt for carbonhydrider, alkoholer og syrer, C1-C16, angivet i °F | |||||||||||||||||||||
| Kulstofnummer | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | |||||
| Alkylcyclohexan* | -197 | -171 | -139 | -108 | -72 | -54 | -24 | -5 | 14 | 29 | |||||||||||
| 2,2-dimetylalkan | 2 | -148 | -189 | -186 | -171 | ||||||||||||||||
| 3-methylalkan | -180 | -182 | -186 | -162 | -121 | -112 | -72 | ||||||||||||||
| Alkylbenzen* | 42 | -139 | -139 | -147 | -126 | -103 | -82 | -54 | -33 | -11 | 6 | ||||||||||
| Alkylcyclopentan | -224 | -217 | -179 | -162 | -117 | -99 | -78 | -48 | -20 | -8 | |||||||||||
| 2-methylalkan | -255 | -256 | -245 | -180 | -166 | -112 | -103 | -56 | -53 | ||||||||||||
| 1-alken | -273 | -302 | -302 | -265 | -220 | -182 | -151 | -114 | -87 | -56 | -31 | -10 | 9 | 25 | 40 | ||||||
| 2-methylalken | -221 | -216 | -213 | -153 | -130 | -108 | -83 | -60 | |||||||||||||
| N-alkan | -297 | -297 | -306 | -217 | -201 | -140 | -131 | -70 | -64 | -21 | -14 | -14 | 15 | ||||||||
| 1-alkyne | -113 | -153 | -194 | -158 | -205 | -114 | -111 | -58 | -47 | -13 | -2 | 34 | 59 | ||||||||
| 3-alkanol | -94 | -94 | -49 | 72 | 19 | ||||||||||||||||
| Cycloalken** | -211 | -154 | -67 | ||||||||||||||||||
| 4-alkanol | -42 | -41 | 12 | ||||||||||||||||||
| 2-alkanol | -126 | -127 | -99 | -9 | -25 | -31 | 23 | 32 | 66 | ||||||||||||
| 1-alkanol | -144 | -173 | -192 | -127 | -108 | -52 | -28 | 6 | 23 | 45 | 62 | 76 | 88 | 100 | 111 | ||||||
| Cykloalkan** | -199 | -131 | -137 | 44 | 18 | 59 | 51 | 51 | |||||||||||||
| Alkansyre | 47 | 47 | 63 | -5 | 23 | -28 | 25 | 19 | 62 | 54 | 89 | 83 | 111 | 107 | 145 | ||||||
| 1-alkylnaphthalen | 177 | -24 | 7 | 17 | -3 | -12 | 0 | 0 | |||||||||||||
| * C#(N-alkyl)=0-10 | |||||||||||||||||||||
| ** ringe uden substituenter | |||||||||||||||||||||
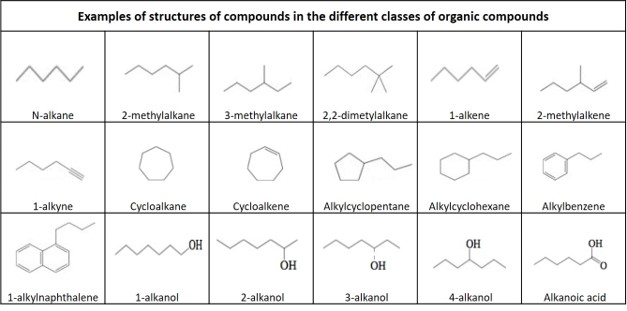
Definitioner af organiske forbindelser
Kulbrinte: En organisk forbindelse, der udelukkende består af hydrogen og carbon.
Hovedgrupper af carbonhydrider:
Alkan: En acyklisk mættet carbonhydrid med den generelle formel CnH2n+2. Også kaldet paraffin.
Alken: Et umættet kulbrinte, der indeholder mindst én kulstof-kulstof-dobbeltbinding, med den generelle formel CnH2n. Også kaldet olefine.
Alkine: Et umættet carbonhydrid, der indeholder mindst én kulstof-kulstof-dobbeltbinding, med den generelle formel CnH2n-2. Også kaldet acetylen.
Cycloalkan: Et mættet carbonhydrid med én ring (monocyklisk), mættet carbonhydrid, med den generelle formel CnH2n. Også kaldet naphthen.
Cycloalken: En alken-kulbrinte, som indeholder en lukket ring af kulstofatomer, men som ikke har aromatisk karakter, med den generelle formel CnH2n-2. Også kaldet cycloolefin.
Aromatisk kulbrinte: Et cyklisk (ringformet), plant (fladt) molekyle med en ring af resonansbindinger, der udviser større stabilitet end andre geometriske eller forbindelsesarrangementer med samme sæt af atomer. De enkleste af de aromatiske stoffer har 6 kulstofatomer og indeholder 3 dobbeltbindinger. Et aromatisk stof med én ring uden nogen substituenter kaldes benzen med formlen C6H6.
Polycykliske aromatiske kulbrinter: kulbrinter, der er sammensat af flere aromatiske ringe. Et aromatisk stof med to ringe uden nogen substituenter kaldes naftalen, med formlen C10H8.
Nogle undergrupper af kulbrinter, der er angivet i dette dokument:
Alkyl: En alkansubstituent, der mangler et hydrogen, med den generelle formel CnH2n+1
2-Methylalkan: En forgrenet alkan, med en methylgruppe forbundet til det andet kulstofatom i hovedkulstofkæden.
3-Methylalkan: En forgrenet alkan, med en methylgruppe forbundet til det tredje kulstofatom i hovedkulstofkæden.
2-Methylalken: En forgrenet alkan, med en methylgruppe forbundet til det tredje kulstofatom i hovedkulstofkæden.
2-Methylalken: En forgrenet alken med en methylgruppe forbundet til det andet kulstofatom i hovedkulstofkæden.
Alkylcycklohexan: En forgrenet alken med en methylgruppe forbundet til det andet kulstofatom i hovedkulstofkæden: En monosubstitueret cyclohexan med en forgrening via tilknytning af en alkylgruppe på et kulstof i cyclohexanringen, med den generelle formel CnH(2n+1)C6H11.
Alkylcycklopentan: Et alkylcyklopentan: En monosubstitueret cyclopentan med en forgrening via tilknytning af en alkylgruppe på et kulstof i cyclohexanringen, med den generelle formel CnH2n+1C5H9.
Alkylbenzen: En monosubstitueret benzen med en forgrening via tilknytning af en alkylgruppe på et kulstof i benzenringen, med den generelle formel CnH(2n+1)C6H5.
Alkylnaphthalen: En monosubstitueret benzen med en forgrening via tilknytning af en alkylgruppe på et kulstof i benzenringen, med den generelle formel CnH(2n+1)C6H5: En monosubstitueret naphthalen med en forgrening via tilknytning af en alkylgruppe på et kulstof i en af de aromatiske ringe, med den generelle formel CnH(2n+1)C10H7.
Nogle andre grupper af organiske forbindelser:
Alkohol: En organisk forbindelse, hvor den funktionelle hydroxylgruppe (-OH) er bundet til et mættet kulstofatom
Alkanol: En organisk forbindelse, hvor den funktionelle hydroxylgruppe (-OH) er bundet til et mættet kulstofatom
Alkanol: Alkohol: En alkohol, hvor hydroxylgruppen er bundet til en alkan
Karboxylsyre: En organisk forbindelse, der indeholder en carboxylgruppe (C(=O)OH). Den generelle formel for en carboxylsyre er R-COOH, hvor R henviser til resten af molekylet.
Alkansyre: En carboxylsyre, hvor R er en alkan.