Fedt er måske et af de mest undervurderede væv i kroppen. Det består af lipidfyldte modne adipocytter og forstadier til stamceller samt andre specialiserede celletyper, der alle er viklet ind i et netværk af ekstracellulær matrix, blodkar og nerver. Fedtvævet er således ikke den klump inaktivt spæk, som det kan se ud til at være. De kritiske roller, som fedtvævet spiller for menneskers sundhed, overses faktisk stadig ofte. I stedet kan det blive ignoreret som en irrelevans, en kosmetisk ufuldkommenhed eller antaget at være “en dårlig ting”, selv om det faktisk udfører (eller burde udføre) en række bemærkelsesværdige og komplekse funktioner.
ADIPOCYTES AS EXPANDABLE STORAGE
Vigtigheden af et velfungerende fedtvæv illustreres tydeligst af sjældne individer, der lider af en generel mangel på fedt, eller lipodystrofi, som fører til flere endokrine og metaboliske problemer.
Modsat er det sandsynligt, at de mekanismer, der ligger til grund for disse problemer, er fælles for overvægtige individer. Dette blev sandsynligvis først formuleret af RD Lawrence allerede i 1946.1 Han beskrev en patient med lipodystrofi, fedtlever og diabetes og bemærkede, at “der ikke kunne lagres noget fedt i de sædvanlige depoter, og derfor cirkulerede det i overskud og producerede lipaemia”. Han fortsatte med at diskutere diabetes i forbindelse med fedme og opstillede den hypotese, at dette skyldes “en sådan overfyldning af fedtdepoterne, at de ikke længere kan acceptere og absorbere et overskud af sukker fra maden”. Som sådan identificerede han elegant, at manglen på tilgængelig lagerkapacitet er en mekanisme, hvormed manglende fedtudvikling eller overekspansion af fedtvævet kan forårsage lignende sundhedsproblemer.
Dermed er fedtvævets første, og næsten helt sikkert mest kritiske, opgave at fungere som et sikkert lager for lipider. Hvis denne kapacitet går tabt, fører det til uhensigtsmæssig lipidophobning og dysfunktion i andre væv.
Fedtvæv er også en let mobiliseret energikilde, når det er nødvendigt. Dette kræver en kompleks koordineret reaktion på endokrine og neuronale signaler for præcist at regulere næringsstofoptagelse, forarbejdning, lagring, nedbrydning og frigivelse.2 Den typiske hvide adipocyt kan måle over 0,1 mm i diameter. Mindst 90 % af dens volumen er optaget af en enkelt, stor lipiddråbe. Alt andet, som denne celle skal gøre, foregår i en tynd, omgivende “hud” af cytoplasma. I betragtning af rækkevidden af dens evner er dette en bemærkelsesværdig præstation.
En af adipocyttens andre vigtige roller er at udskille lokale og systemisk virkende endokrine faktorer.3 De mest kendte af disse er formentlig den centralt virkende mætningsfaktor leptin og proteinet adiponectin, hvis niveauer er tæt korreleret med insulinfølsomhed. Der er imidlertid beskrevet mange andre med en forvirrende række af virkninger, hvoraf nogle er gavnlige og andre skadelige for den enkeltes metaboliske sundhed. Ud over disse roller kan fedtvæv fungere som en mekanisk barriere mod skader og isolere mod kulde.
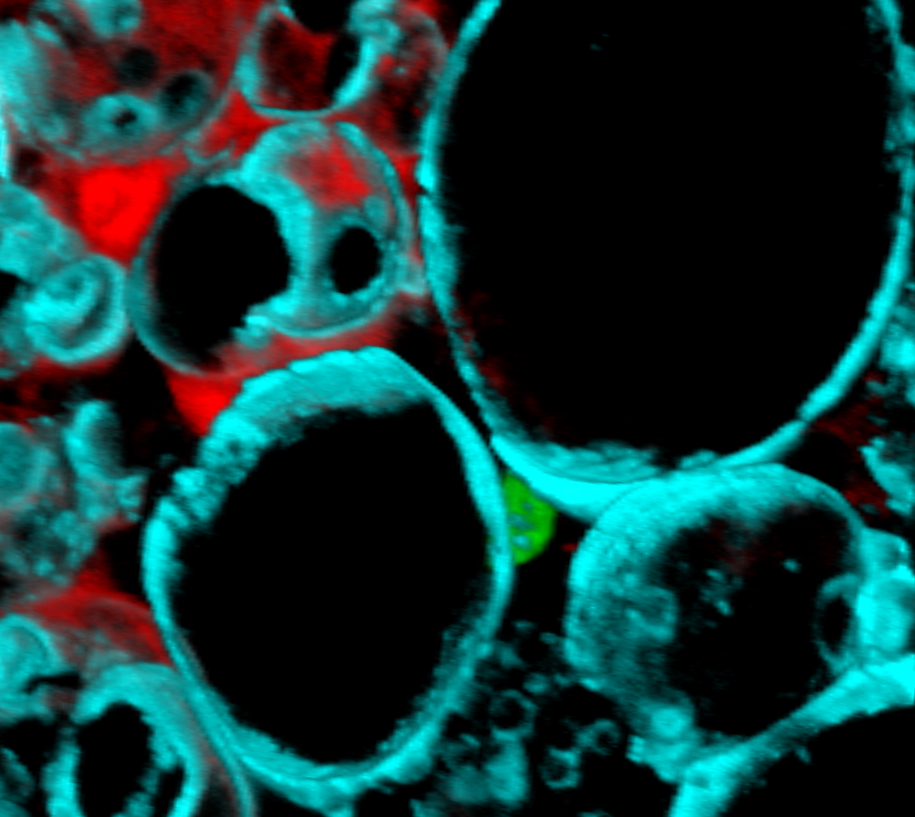
3D-gengivelse af et 100-µm tykt snit af murint fedtvæv i nyren. Immunofluorescerende farvning for lipiddråbeproteinet perilipin er i cyan. Et liniesporende Cre-induceret tdTomato fluorescerende protein mærker en delmængde af adipocytter rødt. I midten er kernen af en resident fedtstamcelle mærket grønt. ©J. Rochford
LOKALITET, LOKALITET, LOKALITET
Hvor fedt ophobes i kroppen kan have markant forskellige virkninger på helbredet. Subkutant hvidt fedtvæv er generelt gavnligt, mens udvidelse af visceralt hvidt fedtvæv i forbindelse med fedme er stærkt korreleret med metaboliske sygdomme. Dette brede udsagn dækker imidlertid over, at de forskellige fedtdepoter er højt specialiserede og varierer i funktion.
For eksempel øges knoglemarvsfedtvævet i modsætning til andet fedt under kalorierestriktion.4 Knoglemarvsfedt kan faktisk underopdeles i mindst to anatomisk og funktionelt forskellige typer. Der findes flere depoter af termogen brunt fedtvæv samt celler, der deler nogle træk fra både hvide og brune adipocytter (såkaldte brite- eller beige adipocytter). Deres tilstedeværelse hos voksne mennesker har ført til en intens interesse for at udnytte deres evne til at “forbrænde” lagrede lipider og derefter sprede energien som en anti-fedmebehandling5 . Samlet set kunne en målretning af udviklingen eller funktionen af definerede fedttyper fremme metabolisk sundt fedtvæv med mulighed for at forbedre sundheden ved fedme betydeligt.
“Fedtvævets første, og næsten helt sikkert mest kritiske opgave er at fungere som et sikkert lager for lipider.”
UNDEREXPLOREREDE DEPOTER: FAT IN FUNNY PLACES
Selvom systemiske virkninger kan fedtvæv også mere specifikt påvirke nært beslægtede væv. Perivaskulært fedtvæv kan lokalt påvirke den vaskulære funktion. Fedtvæv i leddene spiller en nøglerolle i deres vedligeholdelse, og ændringer i dets funktion bidrager til ledlidelser som f.eks. slidgigt. Der findes små depoter af adipocytter i eller ved siden af hjertet, nyrerne, øjnene og andre steder. Ved at skille ud, hvad de hver især gør på deres specifikke sted, vil der sandsynligvis blive afsløret ny viden om adipocytternes funktion, som er blevet overset ved mere generiske analyser af velundersøgte fedtdepoter.
De adipocytter, der udgør forskellige depotområder, kan udvikle sig fra flere forskellige populationer af stamceller, hvis karakter kan diktere den overordnede funktion af de væv, de danner.6 Forståelsen af deres identitet og potentiale har betydning ud over fedtets funktion, da stamceller isoleret fra fedtvæv er blevet anvendt terapeutisk til at generere en række celletyper.
Sådan kompleksitet er adipocytternes oprindelse og funktioner mellem og inden for forskellige depoter. Nogle er dedikeret til langtidsopbevaring, nogle udgør en brændstofkilde på stedet, mens andre frigiver endokrine signaler eller genererer varme. Rækkevidden af evner er bemærkelsesværdig. Ikke dårligt for den ydmyge fedtcelle.
Justin Rochford, Reader in Metabolic Health, Rowett Institute, University of Aberdeen, UK
- Lawrence RD 1946 Lancet 247 773-775.
- Scheller EL et al. 2016 Trends in Endocrinology and Metabolism 27 392-403.
- Kajimura S et al. 2015 Cell Metabolism 22 546-559.
- Sanchez-Gurmaches J & Guertin DA 2014 Biochimica et Biophysica Acta 1842 340-351.
Morigny P et al. 2016 Biochimie 125 259-266. Choi CHJ & Cohen P 2017 Experimental Cell Research doi:10.1016/ j.yexcr.2017.04.022.