Lernziele
- Erläutern Sie, warum die Siedepunkte von Alkoholen höher sind als die von Ethern und Alkanen ähnlicher Molmassen.
- Erläutern Sie, warum Alkohole und Ether mit vier oder weniger Kohlenstoffatomen in Wasser löslich sind, während vergleichbare Alkane nicht löslich sind.
Alkohole können als Derivate von Wasser (H2O; auch als HOH geschrieben) betrachtet werden.

Wie die H-O-H-Bindung in Wasser ist auch die R-O-H-Bindung gebogen, und Alkoholmoleküle sind polar. Diese Beziehung ist bei kleinen Molekülen besonders deutlich und spiegelt sich in den physikalischen und chemischen Eigenschaften der Alkohole mit geringer Molmasse wider. Ersetzt man ein Wasserstoffatom eines Alkans durch eine OH-Gruppe, können sich die Moleküle durch Wasserstoffbrückenbindungen verbinden (Abbildung \(\PageIndex{1}\)).
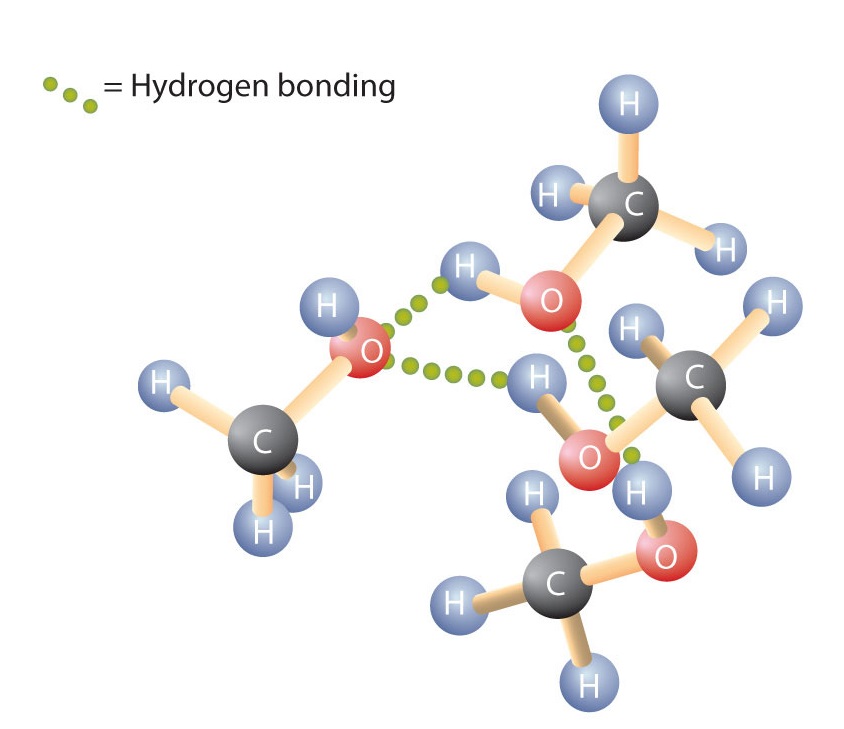
Erinnern Sie sich daran, dass physikalische Eigenschaften in hohem Maße durch die Art der zwischenmolekularen Kräfte bestimmt werden. In der Tabelle \(\PageIndex{1}\) sind die Molmassen und die Siedepunkte einiger häufiger Verbindungen aufgeführt. Die Tabelle zeigt, dass Stoffe mit ähnlichen Molmassen ganz unterschiedliche Siedepunkte haben können.
| Formel | Name | Molmasse | Siedepunkt (°C) |
|---|---|---|---|
| CH4 | Methan | 16 | -164 |
| HOH | Wasser | 18 | 100 |
| C2H6 | Ethan | 30 | -89 |
| CH3OH | Methanol | 32 | 65 |
| C3H8 | Propan | 44 | -42 |
| CH3CH2OH | Ethanol | 46 | 78 |
| C4H10 | Butan | 58 | -1 |
| CH3CH2CH2OH | 1-Propanol | 60 | 97 |
Alkane sind unpolar und werden daher nur durch relativ schwache Dispersionskräfte verbunden. Alkane mit einem bis vier Kohlenstoffatomen sind bei Raumtemperatur Gase. Im Gegensatz dazu ist selbst Methanol (mit einem Kohlenstoffatom) bei Raumtemperatur flüssig. Durch Wasserstoffbrückenbindungen sind die Siedepunkte von Alkoholen im Vergleich zu Kohlenwasserstoffen mit vergleichbarer Molmasse stark erhöht. Der Siedepunkt ist ein grobes Maß für die Energiemenge, die erforderlich ist, um ein flüssiges Molekül von seinen nächsten Nachbarn zu trennen. Wenn die Moleküle über Wasserstoffbrückenbindungen miteinander wechselwirken, muss eine relativ große Energiemenge zugeführt werden, um diese intermolekularen Anziehungen zu brechen. Erst dann kann das Molekül aus dem flüssigen in den gasförmigen Zustand übergehen.
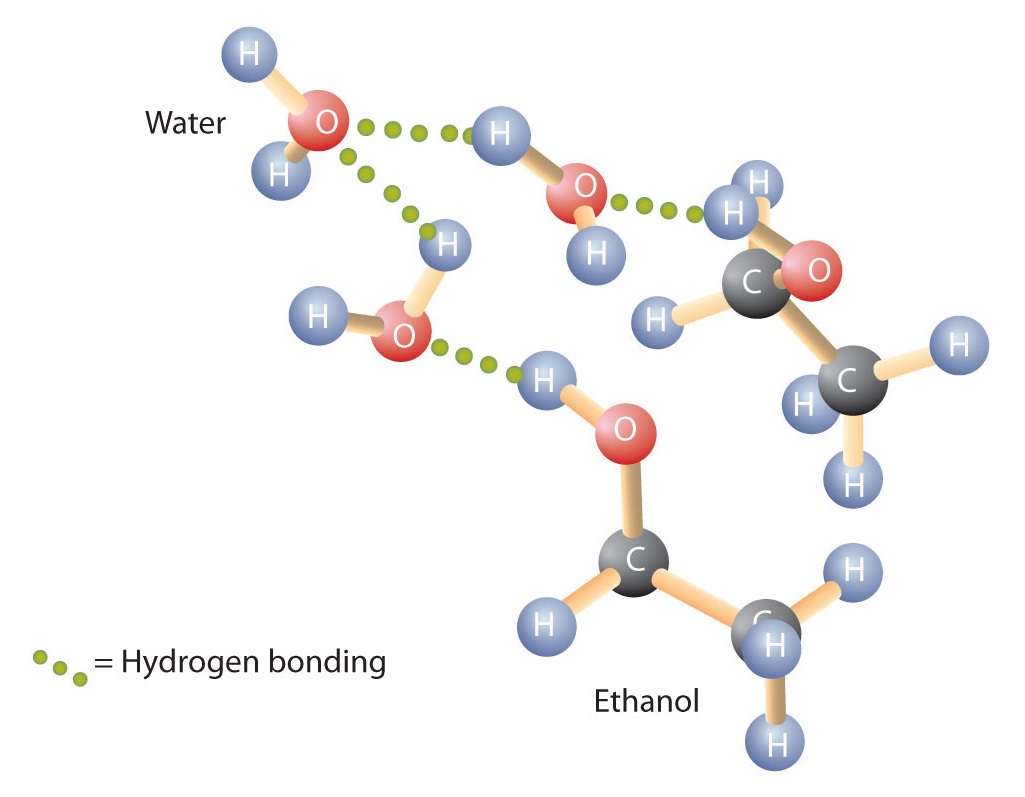
Auch Alkohole können mit Wassermolekülen Wasserstoffbrückenbindungen eingehen (Abbildung \(\PageIndex{2}\)). Während also die Kohlenwasserstoffe in Wasser unlöslich sind, sind Alkohole mit einem bis drei Kohlenstoffatomen vollständig löslich. Mit zunehmender Kettenlänge nimmt die Löslichkeit der Alkohole in Wasser jedoch ab; die Moleküle ähneln dann mehr den Kohlenwasserstoffen und weniger dem Wasser. Der Alkohol 1-Decanol (CH3CH2CH2CH2CH2CH2CH2CH2CH2CH2OH) ist im Wesentlichen unlöslich in Wasser. Wir stellen häufig fest, dass die Grenze der Löslichkeit in einer Familie von organischen Verbindungen bei vier oder fünf Kohlenstoffatomen liegt.
Zusammenfassung
Alkohole haben höhere Siedepunkte als Ether und Alkane ähnlicher Molmassen, weil die OH-Gruppe den Alkoholmolekülen erlaubt, Wasserstoffbrückenbindungen einzugehen. Alkohole mit vier oder weniger Kohlenstoffatomen sind in Wasser löslich, weil die Alkoholmoleküle Wasserstoffbrückenbindungen mit Wassermolekülen eingehen; vergleichbare Alkanmoleküle können keine Wasserstoffbrückenbindungen eingehen.
Übungen zur Überprüfung des Konzepts
-
Warum ist Ethanol besser in Wasser löslich als 1-Hexanol?
-
Warum hat 1-Butanol einen niedrigeren Siedepunkt als 1-Hexanol?
Antworten
-
Ethanol hat eine OH-Gruppe und nur 2 Kohlenstoffatome; 1-Hexanol hat eine OH-Gruppe für 6 Kohlenstoffatome und ist daher eher ein (unpolarer) Kohlenwasserstoff als Ethanol.
-
Die molare Masse von 1-Hexanol ist größer als die von 1-Butanol.
Übungen
Beantworten Sie die folgenden Aufgaben, ohne Tabellen im Text zu Rate zu ziehen.
-
Reihen Sie diese Alkohole in der Reihenfolge ihres zunehmenden Siedepunktes an: Ethanol, Methanol und 1-Propanol.
-
Welcher hat den höheren Siedepunkt – Butan oder 1-Propanol?
-
Reihen Sie diese Alkohole in der Reihenfolge ihrer zunehmenden Löslichkeit in Wasser an: 1-Butanol, Methanol und 1-Octanol.
-
Reihen Sie diese Verbindungen in der Reihenfolge ihrer zunehmenden Löslichkeit in Wasser an: 1-Butanol, Ethanol und Pentan.
Antworten
-
Methanol < Ethanol < 1-Propanol
-
1-Oktanol < 1-Butanol < Methanol