Entropie
Es gibt in der Natur eine Tendenz, dass Systeme in einen Zustand größerer Unordnung oder Zufälligkeit übergehen. Die Entropie ist ein Maß für den Grad der Zufälligkeit oder Unordnung in einem System. Die Entropie ist ein leicht zu verstehendes Konzept, wenn man über alltägliche Situationen nachdenkt. Die Entropie eines Raums, der erst kürzlich gereinigt und aufgeräumt wurde, ist gering. Im Laufe der Zeit wird er wahrscheinlich unordentlicher werden, so dass seine Entropie zunimmt (siehe Abbildung unten). Die natürliche Tendenz eines Systems ist, dass seine Entropie zunimmt.
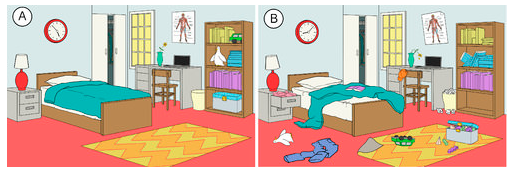
Chemische Reaktionen neigen auch dazu, so abzulaufen, dass die Gesamtentropie des Systems steigt. Wie kann man feststellen, ob eine bestimmte Reaktion eine Zunahme oder eine Abnahme der Entropie aufweist? Der molekulare Zustand der Reaktanten und Produkte liefert einige Anhaltspunkte. Die folgenden allgemeinen Fälle veranschaulichen die Entropie auf molekularer Ebene.
- Für einen bestimmten Stoff ist die Entropie im flüssigen Zustand größer als die Entropie im festen Zustand. Ebenso ist die Entropie des Gases größer als die Entropie der Flüssigkeit. Daher steigt die Entropie bei Prozessen, bei denen aus festen oder flüssigen Reaktanten gasförmige Produkte entstehen. Die Entropie nimmt auch zu, wenn feste Reaktanten flüssige Produkte bilden.
- Die Entropie nimmt zu, wenn ein Stoff in mehrere Teile zerlegt wird. Der Vorgang des Auflösens erhöht die Entropie, weil die gelösten Teilchen bei der Bildung einer Lösung voneinander getrennt werden.
- Die Entropie steigt mit zunehmender Temperatur. Eine Temperaturerhöhung bedeutet, dass die Teilchen des Stoffes eine größere kinetische Energie haben. Die sich schneller bewegenden Teilchen haben mehr Unordnung als Teilchen, die sich bei einer niedrigeren Temperatur langsamer bewegen.
- Entropie nimmt im Allgemeinen bei Reaktionen zu, bei denen die Gesamtzahl der Produktmoleküle größer ist als die Gesamtzahl der Reaktantenmoleküle. Eine Ausnahme von dieser Regel ist die Erzeugung eines Gases aus nicht gasförmigen Reaktanten.
Die folgenden Beispiele sollen veranschaulichen, wie die Entropieänderung bei einer Reaktion vorhergesagt werden kann.
\(\ce{Cl_2} \left( g \right) \rightarrow \ce{Cl_2} \left( l \right)\)
Die Entropie nimmt ab, weil ein Gas zu einer Flüssigkeit wird.
\(\ce{CaCO_3} \left( s \right) \rightarrow \ce{CaO} \left( s \right) + \ce{CO_2} \left( g \right)\)
Die Entropie nimmt zu, weil ein Gas erzeugt wird und die Anzahl der Moleküle steigt.
\(\ce{N_2} \left( g \right) + 3 \ce{H_2} \left( g \right) \rightarrow 2 \ce{NH_3} \left( g \right)\)
Die Entropie nimmt ab, weil insgesamt vier Eduktmoleküle zwei Produktmoleküle bilden. Alle sind Gase.
\(\ce{AgNO_3} \left( aq \right) + \ce{NaCl} \links( aq \rechts) \rightarrow \ce{NaNO_3} \left( aq \right) + \ce{AgCl} \left( s \right)\)
Die Entropie nimmt ab, weil sich aus wässrigen Reaktanten ein Feststoff bildet.
\(\ce{H_2} \left( g \right) + \ce{Cl_2} \left( g \right) \rightarrow 2 \ce{HCl} \left( g \right)\)
Die Entropieänderung ist unbekannt (aber wahrscheinlich nicht Null), da sich auf beiden Seiten der Gleichung gleich viele Moleküle befinden und alle Gase sind.