Das Atommodell
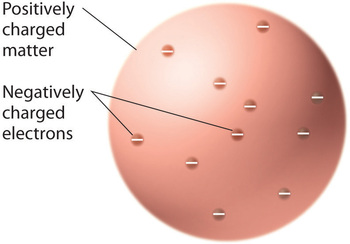
Als die Wissenschaftler zu dem Schluss kamen, dass alle Materie negativ geladene Elektronen enthält, wurde klar, dass Atome, die elektrisch neutral sind, auch positive Ladungen enthalten müssen, um die negativen auszugleichen. Thomson schlug vor, dass die Elektronen in eine einheitliche Kugel eingebettet sind, die sowohl die positive Ladung als auch den größten Teil der Masse des Atoms enthält, ähnlich wie Rosinen in Pflaumenpudding oder Schokoladenstückchen in einem Keks (Abbildung \(\PageIndex{9}\))
2.4.6
Abbildung \(\PageIndex{9}\): Thomson’s Plum Pudding oder Chocolate Chip Cookie Modell des Atoms. In diesem Modell sind die Elektronen in eine einheitliche Kugel mit positiver Ladung eingebettet. Bild mit Erlaubnis verwendet (CC BY-SA-NC).
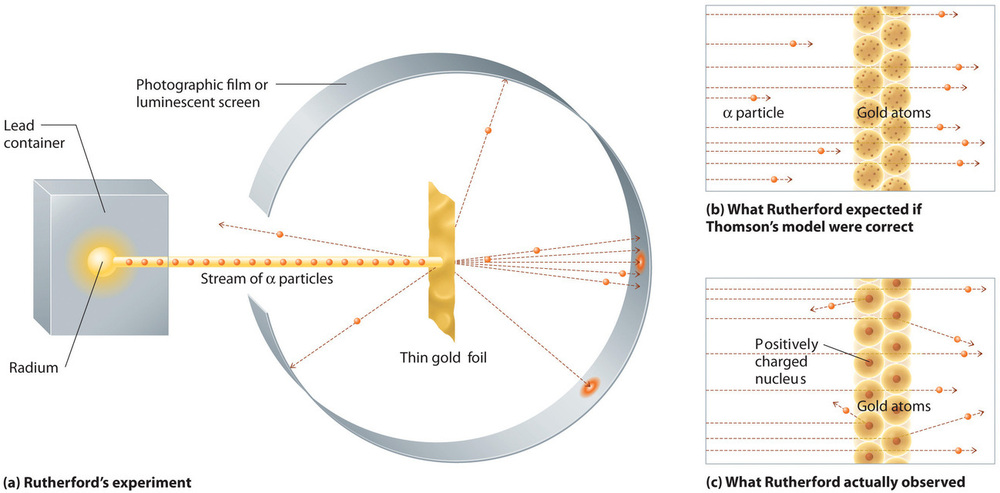
In einem einzigen berühmten Experiment zeigte Rutherford jedoch eindeutig, dass Thomsons Atommodell falsch war. Rutherford richtete einen Strom von α-Teilchen auf ein sehr dünnes Goldfolientarget (Abbildung \(\PageIndex{10a}\)) und untersuchte, wie die α-Teilchen an der Folie gestreut wurden. Gold wurde gewählt, weil es leicht in extrem dünne Platten gehämmert werden kann, wodurch die Anzahl der Atome im Ziel minimiert wird. Wenn das Thomson’sche Atommodell richtig wäre, müssten die positiv geladenen α-Teilchen durch die gleichmäßig verteilte Masse des Goldtargets wie Kanonenkugeln durch die Wand eines Holzhauses krachen. Sie bewegten sich vielleicht etwas langsamer, als sie auftauchten, aber sie sollten im Wesentlichen gerade durch das Ziel hindurchgehen (Abbildung \(\PageIndex{10b}\)). Zu Rutherfords Erstaunen wurde ein kleiner Teil der α-Teilchen in großen Winkeln abgelenkt, und einige wurden direkt auf die Quelle zurückgeworfen (Abbildung \(\PageIndex{10c}\)). Rutherford sagte: „Es war fast so unglaublich, als ob man eine 15-Zoll-Granate auf ein Stück Seidenpapier schießen würde und es zurückkäme und einen selbst treffen würde.“
2.4.7
Abbildung \(\PageIndex{10}\): Eine Zusammenfassung von Rutherfords Experimenten. (a) Eine Darstellung der Apparatur, die Rutherford verwendete, um Ablenkungen in einem Strom von α-Teilchen festzustellen, die auf ein dünnes Goldfolientarget gerichtet waren. Die Teilchen wurden von einer Radiumprobe erzeugt. (b) Wäre das Thomson’sche Atommodell korrekt, hätten die α-Teilchen die Goldfolie gerade durchdringen müssen. (c) Eine kleine Anzahl von α-Teilchen wurde jedoch in verschiedene Richtungen abgelenkt, unter anderem direkt zurück zur Quelle. Dies konnte nur der Fall sein, wenn die positive Ladung viel massiver war als das α-Teilchen. Dies deutet darauf hin, dass die Masse des Goldatoms in einem sehr kleinen Bereich des Raums konzentriert ist, den er als Kern bezeichnete. Bild verwendet mit Genehmigung (CC BY-SA-NC).
Rutherfords Ergebnisse stimmten nicht mit einem Modell überein, in dem die Masse und die positive Ladung gleichmäßig über das Volumen eines Atoms verteilt sind. Stattdessen deuteten sie stark darauf hin, dass sowohl die Masse als auch die positive Ladung in einem winzigen Bruchteil des Volumens eines Atoms konzentriert sind, den Rutherford den Kern nannte. Es war logisch, dass ein kleiner Teil der α-Teilchen mit den dichten, positiv geladenen Kernen kollidierte, und zwar entweder streifend, was zu großen Ablenkungen führte, oder fast frontal, was dazu führte, dass sie direkt zur Quelle zurückgeworfen wurden.
Obwohl Rutherford nicht erklären konnte, warum Abstoßungen zwischen den positiven Ladungen in Kernen, die mehr als eine positive Ladung enthielten, nicht zum Zerfall des Kerns führten, schlussfolgerte er, dass Abstoßungen zwischen negativ geladenen Elektronen dazu führen würden, dass die Elektronen gleichmäßig über das gesamte Volumen des Atoms verteilt werden.
Heute weiß man, dass starke Kernkräfte, die viel stärker sind als elektrostatische Wechselwirkungen, die Protonen und Neutronen im Kern zusammenhalten. Für diese und andere Erkenntnisse wurde Rutherford 1908 mit dem Nobelpreis für Chemie ausgezeichnet. Leider hätte Rutherford lieber den Nobelpreis für Physik erhalten, denn er hielt die Physik für der Chemie überlegen. Seiner Meinung nach ist „alle Wissenschaft entweder Physik oder Briefmarkensammeln“
 2.4.8
2.4.8
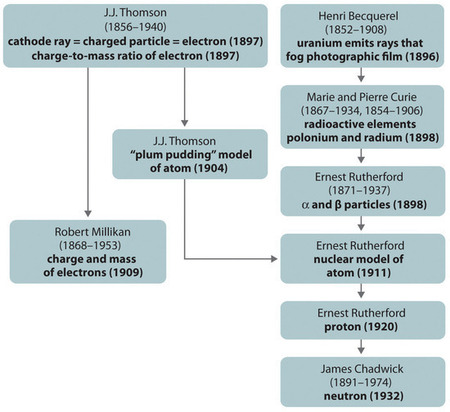
Abbildung \(\PageIndex{11}\): Eine Zusammenfassung der historischen Entwicklung der Modelle der Bestandteile und der Struktur des Atoms. Die Daten in Klammern sind die Jahre, in denen die wichtigsten Experimente durchgeführt wurden. Bild mit Genehmigung verwendet (CC BY-SA-NC).
Die historische Entwicklung der verschiedenen Modelle des Atomaufbaus ist in (Abbildung \(\PageIndex{11}\)) zusammengefasst Rutherford stellte fest, dass der Kern des Wasserstoffatoms ein positiv geladenes Teilchen ist, wofür er 1920 den Namen Proton prägte. Er schlug auch vor, dass die Kerne anderer Elemente als Wasserstoff elektrisch neutrale Teilchen mit ungefähr der gleichen Masse wie das Proton enthalten müssen. Das Neutron wurde jedoch erst 1932 von James Chadwick (1891-1974, einem Schüler Rutherfords; Nobelpreis für Physik, 1935) entdeckt. Durch Rutherfords Arbeit wurde klar, dass ein α-Teilchen zwei Protonen und Neutronen enthält und somit der Kern eines Heliumatoms ist.
2.4.9
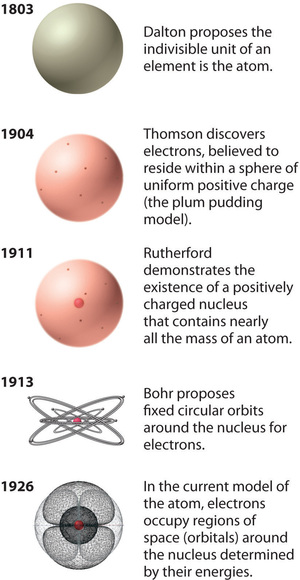
Abbildung \(\PageIndex{12}\): Die Entwicklung der Atomtheorie, veranschaulicht durch Modelle des Sauerstoffatoms. Bohrs Modell und das aktuelle Modell werden in Kapitel 6, „Die Struktur der Atome“, beschrieben. Bild mit Erlaubnis verwendet (CC BY-SA-NC).
Rutherfords Atommodell entspricht im Wesentlichen dem modernen Modell, mit der Ausnahme, dass man inzwischen weiß, dass die Elektronen nicht gleichmäßig über das Volumen eines Atoms verteilt sind. Stattdessen sind sie nach einer Reihe von Prinzipien verteilt, die in der Quantenmechanik beschrieben werden. Abbildung \(\PageIndex{12}\) zeigt, wie sich das Modell des Atoms im Laufe der Zeit von der unteilbaren Einheit von Dalton zu der heute gelehrten modernen Sichtweise entwickelt hat.