Die autoimmunhämolytische Anämie (AIHA) wird durch Antikörper vermittelt, wobei in den meisten Fällen Immunglobulin (Ig) G der vermittelnde Antikörper ist. Diese Art der AIHA wird als „warme“ AIHA bezeichnet, da IgG-Antikörper bei Körpertemperatur am besten binden. Die „kalte“ AIHA wird durch IgM-Antikörper vermittelt, die bei Temperaturen unter 37 °C am besten binden. AIHA, die durch eine Arzneimittelreaktion verursacht wird, ist selten, mit einer geschätzten jährlichen Inzidenz von 1:1.000.000 für schwere arzneimittelbedingte AIHA.1 Dieser Artikel gibt einen Überblick über die Behandlung der häufigsten AIHA-Typen, wobei der Schwerpunkt auf warmer, kalter und arzneimittelbedingter AIHA liegt; die Bewertung und Diagnose von AIHA wird in einem separaten Artikel behandelt.
Warme autoimmunhämolytische Anämie
Bei AIHA wird die Hämolyse durch Antikörper vermittelt, die an die Oberfläche der roten Blutkörperchen binden. AIHA, bei der IgG-Antikörper die angreifenden Antikörper sind, wird als warme AIHA bezeichnet. „Warm“ bezieht sich auf die Tatsache, dass die Antikörper am besten bei Körpertemperatur (37 °C) binden. Bei warmer AIHA werden bei Tests IgG-Moleküle an der Oberfläche der Erythrozyten nachgewiesen, bei 50 % der Patienten auch C3. Zwischen 50 % und 90 % der AIHA-Fälle sind auf warme Antikörper zurückzuführen.2,3 Die Häufigkeit der warmen AIHA variiert je nach Serie, liegt aber bei etwa 1 Fall pro 100.000 Patienten pro Jahr; diese Form der Hämolyse betrifft Frauen häufiger als Männer.4,5
Therapieoptionen
Erste Wahl
Steroide. Das Ziel der Therapie bei warmer AIHA ist schwer zu definieren. Die meisten stimmen jedoch darin überein, dass ein Hämatokrit von über 30 % (oder höher, um Symptome zu verhindern) mit einem minimalen Anstieg der Retikulozytenzahl – der auf einen deutlich verlangsamten hämolytischen Prozess hinweist – ein vernünftiges Ziel ist. Die Erstbehandlung der warmen AIHA besteht aus Prednison in einer Standarddosis von 1 mg/kg täglich (Tabelle 1).6,7 Die Patienten sollten außerdem Protonenpumpenhemmer erhalten, um Geschwüre zu verhindern. Es kann bis zu 3 Wochen dauern, bis die Patienten auf die Prednisontherapie ansprechen. Sobald der Hämatokritwert des Patienten über 30 % liegt, wird das Prednison langsam abgesetzt. Obwohl etwa 80 % der Patienten auf die Steroide ansprechen, können nur 30 % vollständig von den Steroiden abgesetzt werden. Für Patienten, die eine tägliche Steroiddosis von 10 mg oder weniger beibehalten können, können Steroide die sinnvollste Langzeittherapie darstellen. Da eine aktive Hämolyse zu einem erhöhten Bedarf an Folsäure führt, wird Patienten mit warmer AIHA häufig 1 mg Folsäure täglich verschrieben, um eine megaloblastische Anämie aufgrund eines Folsäuremangels zu verhindern.
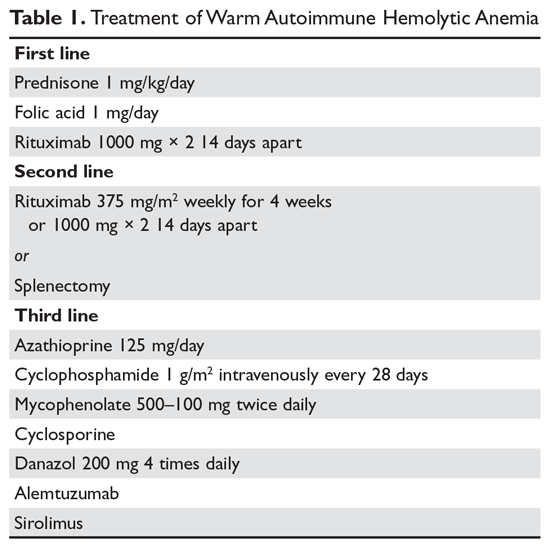
Rituximab. In zunehmendem Maße wird die Therapie mit Rituximab (Anti-CD20) zu den anfänglichen Steroiden hinzugefügt. Zwei klinische Studien haben gezeigt, dass der Einsatz von Rituximab sowohl das Langzeit- als auch das Kurzzeitansprechen erhöht.8,9 Ein wichtiger Aspekt ist, dass die meisten Patienten über Wochen hinweg allmählich auf Rituximab ansprechen, so dass ein schnelles Ansprechen nicht erwartet werden sollte. In den meisten Studien wurde die traditionelle Dosierung von 375 mg/m2 wöchentlich über 4 Wochen verwendet. Diese Reaktionen scheinen dauerhaft zu sein, aber wie bei der Immunthrombozytopenie (ITP) ist eine wiederholte Behandlung mit Rituximab wirksam.
Die wichtigsten Nebenwirkungen von Rituximab sind Infusionsreaktionen, die oft bei der ersten Dosis schlimmer sind. Diese Reaktionen können mit Antihistaminika, Steroiden und, bei schwerem Rigor, mit Meperidin kontrolliert werden. Selten können Patienten eine Neutropenie (etwa 1:500) entwickeln, die offenbar autoimmuner Natur ist. Die Zahl der Infektionen scheint bei der Anwendung von Rituximab nur geringfügig zuzunehmen.10 Eine Risikogruppe sind chronische Träger des Hepatitis-B-Virus, bei denen es zu einer Reaktivierung des Virus kommen kann, die tödlich verlaufen kann. Daher müssen Patienten, bei denen eine Behandlung mit Rituximab in Betracht gezogen wird, auf den Trägerstatus des Hepatitis-B-Virus untersucht werden.11 Bei Patienten, die Rituximab erhalten, besteht ein sehr geringes Risiko für eine progressive multifokale Leukoenzephalopathie, die bei Krebspatienten und bei stark immunsupprimierten Patienten häufiger auftritt. Das Gesamtrisiko ist nicht bekannt, liegt aber bei weniger als 1:50.000.