Autoregulation des zerebralen Blutflusses
Autoregulation des zerebralen Blutflusses ist die Fähigkeit des Gehirns, den Blutfluss trotz Veränderungen des Perfusionsdrucks relativ konstant zu halten. Die Autoregulation ist in vielen Gefäßbetten vorhanden, aber im Gehirn ist sie besonders ausgeprägt, was wahrscheinlich auf die Notwendigkeit einer konstanten Blutversorgung und Wasserhomöostase zurückzuführen ist. Bei normotensiven Erwachsenen wird der zerebrale Blutfluss bei ~50 mL pro 100 g Hirngewebe pro Minute aufrechterhalten, sofern der CPP im Bereich von ~60 bis 160 mmHg liegt. Oberhalb und unterhalb dieser Grenze geht die Autoregulation verloren und der zerebrale Blutfluss wird linear vom mittleren arteriellen Druck abhängig. Wenn der CPP unter die untere Grenze der Autoregulation fällt, kommt es zu einer zerebralen Ischämie. Die Verringerung des zerebralen Blutflusses wird durch einen Anstieg der Sauerstoffextraktion aus dem Blut kompensiert. Klinische Anzeichen oder Symptome einer Ischämie treten erst auf, wenn die Abnahme der Durchblutung die Fähigkeit der erhöhten Sauerstoffextraktion übersteigt, den Stoffwechselbedarf zu decken. Zu diesem Zeitpunkt treten klinische Anzeichen einer Hypoperfusion auf, darunter Schwindel, veränderter mentaler Status und schließlich irreversible Gewebeschäden (Infarkt).
Die Mechanismen der Autoregulation im Gehirn sind nicht vollständig geklärt und unterscheiden sich wahrscheinlich bei Druckanstieg und -abfall. Obwohl eine neuronale Beteiligung an der Autoregulation nahe liegt, haben Studien gezeigt, dass die Autoregulation des zerebralen Blutflusses bei sympathisch und parasympathisch denervierten Tieren erhalten bleibt, was darauf hinweist, dass ein wesentlicher Beitrag extrinsischer neurogener Faktoren zur Autoregulation des zerebralen Blutflusses unwahrscheinlich ist (siehe Perivaskuläre Innervation). Kürzlich wurde gezeigt, dass neuronales Stickoxid bei der Modulation der Autoregulation des zerebralen Blutflusses eine Rolle spielt, was darauf hindeutet, dass die extrinsische Innervation zwar nicht beteiligt ist, aber die intrinsische Innervation eine Rolle spielen könnte. Es wurde auch vorgeschlagen, dass Nebenprodukte des Stoffwechsels eine Rolle bei der Autoregulation spielen. Eine Verringerung des zerebralen Blutflusses stimuliert die Freisetzung vasoaktiver Substanzen aus dem Gehirn, die eine Arterienerweiterung bewirken. Zu den Kandidaten für diese vasoaktiven Substanzen gehören H+, K+, O2, Adenosin und andere. Die Autoregulation des zerebralen Blutflusses bei Druckschwankungen am oberen Ende der Autoregulationskurve ist höchstwahrscheinlich auf das myogene Verhalten der glatten Muskulatur des Gehirns zurückzuführen, die sich als Reaktion auf einen erhöhten Druck zusammenzieht und als Reaktion auf einen verminderten Druck erweitert. Der wichtige Beitrag der myogenen Aktivität zur Autoregulation wurde in vitro an isolierten und unter Druck stehenden Hirnarterien nachgewiesen, die sich als Reaktion auf einen erhöhten Druck zusammenziehen und als Reaktion auf einen verminderten Druck erweitern (siehe Myogene Reaktion). Die Autoregulation bei Drücken unterhalb des myogenen Druckbereichs ist wahrscheinlich mit Hypoxie und der Freisetzung von Stoffwechselfaktoren verbunden.
Die Bedeutung der Autoregulation für die normale Hirnfunktion wird durch die Tatsache unterstrichen, dass erhebliche Hirnschäden auftreten, wenn die Autoregulationsmechanismen verloren gehen. So wird beispielsweise bei akuter Hypertonie mit Drücken oberhalb der Autoregulationsgrenze die myogene Konstriktion der glatten Gefäßmuskulatur durch den übermäßigen intravaskulären Druck überwunden, und es kommt zu einer erzwungenen Dilatation der Hirngefäße. Der Verlust des myogenen Tonus während der erzwungenen Dilatation verringert den zerebrovaskulären Widerstand, was zu einem starken Anstieg des zerebralen Blutflusses (300-400 %) führen kann, der als autoregulatorischer Durchbruch bezeichnet wird (Abbildung 16). Darüber hinaus erhöht der verringerte zerebrovaskuläre Widerstand den hydrostatischen Druck auf das zerebrale Endothel, was zur Bildung von Ödemen führt, die die Ursache von Erkrankungen wie der hypertensiven Enzephalopathie, dem posterioren reversiblen Enzephalopathiesyndrom (PRES) und der Eklampsie sind (siehe Bildung vasogener Ödeme).
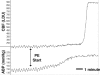
ABBILD 16
Aufzeichnung von CBF (in Laser-Doppler-Einheiten) und ABP (in mmHg) als Reaktion auf steigende Dosen von PE. In diesem Experiment stieg der CBF um das Vierfache gegenüber dem Ausgangswert, als der ABP von 140 auf 210 mmHg anstieg, was einen Durchbruch der Autoregulation zeigt. Verwendet (mehr…)
Obwohl seit dem Aufkommen einer wirksamen antihypertensiven Therapie selten, tritt die hypertensive Enzephalopathie als Folge eines plötzlichen, anhaltenden Blutdruckanstiegs auf, der ausreicht, um die Obergrenze der zerebralen Blutflussautoregulation (>160 mmHg) zu überschreiten. Frühe Studien über die Reaktion der Hirngefäße auf hohen Blutdruck führten zum Konzept des hypertensiven Vasospasmus. Man nahm an, dass die akute hypertensive Enzephalopathie das Ergebnis eines Spasmus – definiert als unkontrollierte Vasokonstriktion – der Hirnarterien ist, der eine Ischämie des Hirngewebes verursacht. Dieses Konzept geht auf die Beobachtungen von Byrom zurück, der eine experimentelle renale Hypertonie erzeugte und feststellte, dass ~90 % der hypertensiven Ratten mit neurologischen Manifestationen multiple kortikale Flecken mit Trypanblau-Extravasation aufwiesen, während Ratten ohne zerebrale Symptome eine normale zerebrovaskuläre Permeabilität zu haben schienen. Außerdem stellte er eine abwechselnde Vasokonstriktion/Vasodilatation in den Pialgefäßen fest, ein Phänomen, das als „Würstchenschnur“ bezeichnet wird. Diese Beobachtung führte ihn zu der Schlussfolgerung, dass zerebraler Vasospasmus als Reaktion auf akuten Bluthochdruck Ischämie und Ödembildung verursacht. Später änderte Byrom seine Ansicht und bezog sich auf einen Befund im Mesenterialkreislauf, wonach Gefäße mit diesem „sausage-string“-Erscheinungsbild nur in den erweiterten Teilen der Gefäße einen Eiweißaustritt aufwiesen. Seitdem ist erwiesen, dass hoher Blutdruck zu einem erhöhten zerebralen Blutfluss und einem „Durchbruch der Autoregulation“ führt. Weitere Experimente bestätigten, dass der Verlust der myogenen Vasokonstriktion während der erzwungenen Dilatation und nicht der Spasmus das entscheidende Ereignis bei der hypertensiven Enzephalopathie ist.