Das chemische Element Helium zählt zu den Edelgasen und Nichtmetallen. Es wurde im Jahr 1895 von William Ramsay entdeckt.

Datenbereich
| Klassifizierung: | Helium ist ein Edelgas und ein Nichtmetall |
| Farbe: | farblos |
| Atomgewicht: | 4.00260 |
| Zustand: | Gas |
| Schmelzpunkt: | -272,2 oC, 0,95 K |
| Anmerkung: Bei normalem Atmosphärendruck erstarrt Helium nicht und hat daher keinen Schmelzpunkt. Der oben angegebene Schmelzpunkt gilt bei einem Druck von 25 Atmosphären. | |
| Siedepunkt: | -268,9 oC, 4.2 K |
| Elektronen: | 2 |
| Protonen: | 2 |
| Neutronen im reichlichsten Isotop: | 2 |
| Elektronenschalen: | 2 |
| Elektronenkonfiguration: | 1s2 |
| Dichte @ 20oC: | 0.0001787 g/cm3 |
Mehr anzeigen, darunter: Wärme, Energie, Oxidation,
Reaktionen, Verbindungen, Radien, Leitfähigkeiten
| Atomvolumen: | 27,2 cm3/mol |
| Struktur: | meist hexagonal dicht gepackt |
| (v.Hoher Druck zur Verfestigung von Helium erforderlich) | |
| Spezifische Wärmekapazität | 5.193 J g-1 K-1 |
| Schmelzwärme | 0.0138 kJ mol-1 |
| Zerstäubungswärme | 0 |
| Verdampfungswärme | 0.0845 kJ mol-1 |
| 1. Ionisierungsenergie | 2372.3 kJ mol-1 |
| 2. Ionisierungsenergie | – |
| 3. Ionisierungsenergie | – |
| Elektronenaffinität | 0 kJ mol-1 |
| Mindestoxidationszahl | 0 |
| Min. gemeinsame Oxidationszahl | 0 |
| Maximale Oxidationszahl | 0 |
| Max. gemeinsame Oxidationszahl | 0 |
| Elektronegativität (Pauling-Skala) | – |
| Polarisierbarkeit Volumen | 0.198 Å3 |
| Reaktion mit Luft | keine |
| Reaktion mit 15 M HNO3 | keine |
| Reaktion mit 6 M HCl | keine |
| Reaktion mit 6 M NaOH | keine |
| Oxid(e) | keine |
| Hydrid(e) | keine |
| Chlorid(e) | keine |
| Atomradius | 31 pm |
| Ionradius (1+ Ion) | – |
| Ionenradius (2+ Ion) | – |
| Ionenradius (3+ Ion) | – |
| Ionenradius (1- Ion) | – |
| Ionenradius (2- Ion) | – |
| Ionenradius (3- Ion) | – |
| Wärmeleitfähigkeit | 0.15 W m-1 K-1 |
| Elektrische Leitfähigkeit | – |
| Gefrier-/Schmelzpunkt: | -272,2 oC, 0.95 K |

Nasa: Ionisierte Heliumatome bei etwa 60.000 °C in der Chromosphäre der Sonne emittieren das auf diesem Bild sichtbare ultraviolette Licht.
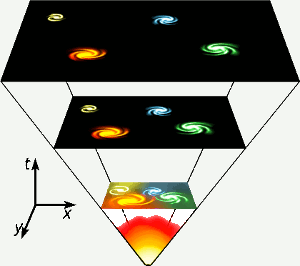
Helium entstand in den ersten drei Minuten der Existenz des Universums, als die Temperaturen überall hoch genug waren, um eine Kernfusion zu ermöglichen. Diese kurze, hochenergetische Phase ist ganz unten im Diagramm dargestellt. Helium entsteht auch durch die Kernfusion von Wasserstoff in Sternen wie unserem eigenen. Bild: Gnixon
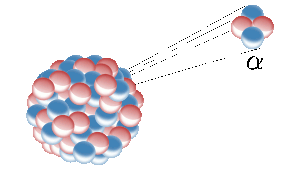
Helium auf der Erde entsteht durch Kernspaltung von radioaktiven Elementen wie Uran. Hier sendet ein radioaktiver Kern einen Heliumkern (auch als Alphateilchen bekannt) aus. Bild: Inductiveload

Spektrum von Helium mit markanter gelber Linie. Bild: Nasa

William Ramsay zeigt auf die letzte Spalte des Periodensystems, die die edlen (oder inerten) Gase enthält. Ramsay erhielt 1904 den Nobelpreis für Chemie für seine Arbeit zur Entdeckung der Edelgase. Bild: Vanity Fair
Entdeckung des Heliums
Die Geschichte der Entdeckung des Heliums ist mit der Entdeckung der Natur der Sterne verwoben.
Es gab eine Zeit, in der man glaubte, wir würden nie erfahren, woraus Sterne bestehen. Im Jahr 1835 erklärte der französische Philosoph Auguste Comte: „Wir werden niemals in der Lage sein, ihre chemische Zusammensetzung zu studieren.“ (1)
Comte war der Meinung, dass wir nur dann erfahren könnten, wie die Sterne beschaffen sind, wenn wir sie ins Labor bringen könnten.
Trotz Comtes Pessimismus war die Methode zur Entdeckung von Helium und der Zusammensetzung der Sterne bereits gefunden worden. 1814 hatte der deutsche Physiker Joseph Fraunhofer Isaac Newtons Methode, das Sonnenlicht mit Hilfe eines Prismas zu spalten, aufgegriffen und einen entscheidenden Fortschritt erzielt. Fraunhofer hatte dunkle Linien im Regenbogen der Farben des durch ein Prisma aufgespaltenen Sonnenlichts bemerkt; die Linien, die er sah, waren die erste Beobachtung des Spektrums eines Sterns überhaupt. (2), (3)
1859/60 machten die deutschen Wissenschaftler Gustav Kirchhoff und Robert Bunsen enorme Fortschritte in der Wissenschaft der Spektroskopie, einschließlich der Entdeckung, dass die dunklen Linien, die Fraunhofer gesehen hatte, wie der Fingerabdruck einer Substanz waren.
Die Weichen für Kirchhoff und Bunsen waren gestellt, um neue Elemente zu entdecken, indem sie das Licht von brennenden Substanzen untersuchten.
1860 entdeckten sie Cäsium durch seine blauen Spektrallinien und 1861 Rubidium durch zwei rote Spektrallinien. Dann entdeckte William Crookes 1861 Thallium, nachdem er eine helle grüne Spektrallinie beobachtet hatte.
Kirchhoff und Bunsen betrachteten das Spektrum der Sonne und konnten daraus schließen, dass in ihrer glühenden Atmosphäre Eisen vorhanden war. (4)
Für die Entdeckung des Heliums brauchte es noch einige Jahre. Im August 1868 stand die erste totale Sonnenfinsternis seit der Veröffentlichung der Arbeiten von Kirchhoff und Bunsen an.
Der französische Astronom Pierre Janssen wartete auf eine Sonnenfinsternis, um mit einem Spektroskop Protuberanzen in der Sonnenkorona zu beobachten. In den zwei Wochen nach der Sonnenfinsternis entwickelte Janssen eine Methode, mit der er die Spektren der Protuberanzen aufzeichnen konnte, ohne dass eine Sonnenfinsternis nötig war. In diesen Spektren beobachtete er eine gelbe Linie. (5)
Die Linie befand sich in einer ähnlichen, aber nicht identischen Position wie die Linien im Spektrum von Natrium. Sie wurden als D1- und D2-Linien bezeichnet. Der englische Wissenschaftler Norman Lockyer untersuchte die neue gelbe Linie, die später als D3-Linie bezeichnet wurde, und veröffentlichte seine Studie, weil er wusste, dass sie von einem neuen Element verursacht werden könnte:
„…wir wussten also, dass wir es nicht mit Wasserstoff zu tun hatten; wir hatten es also mit einem Element zu tun, das wir in unseren Laboratorien nicht bekommen konnten, und deshalb nahm ich die Verantwortung auf mich, das Wort Helium zu prägen, in erster Linie für den Laborgebrauch.“ (6)
Der Name Helium kam vom griechischen Wort für Sonne, helios.
Lockyer und Edward Frankland, sein Mitarbeiter, hatten eine Reihe anderer Ideen über die möglichen Ursachen der gelben Linie und kündigten daher kein neues Element an.
1871 waren sich andere Wissenschaftler der Situation bewusst. Lord Kelvin diskutierte die „Reflexion des Lichts des glühenden Wasserstoffs und des ‚Heliums‘ um die Sonne.“ Auf die Verwendung von „Helium“ folgt eine Fußnote zur Erklärung:
„Frankland und Lockyer finden, dass die gelben Protuberanzen eine sehr entschiedene helle Linie nicht weit von D ergeben, die aber bisher nicht mit einer irdischen Flamme identifiziert wurde. Sie scheint auf eine neue Substanz hinzuweisen, die sie Helium zu nennen vorschlagen.“ (7)
Die Existenz von Helium wurde jedoch nicht von allen akzeptiert. (5)
Alle Zweifel wurden ausgeräumt, als der schottische Chemiker William Ramsay 1895 in London Helium isolierte. Ramsay hatte 1894 Argon mitentdeckt; Argon war das erste der Edelgase, das entdeckt wurde. Im Jahr 1895 las er einen Aufsatz von William Hillebrand, in dem ein nicht reaktionsfähiges Gas beschrieben wurde, das freigesetzt wurde, wenn man dem Uranmineral Uranit Säure hinzufügte. Hillebrand glaubte, dass es sich bei dem Gas um Stickstoff handelte.
Ramsay, der glaubte, das Gas könnte Argon enthalten, wiederholte Hillebrands Experiment mit einem anderen Uranmineral, Cleveit, und sammelte das Gas.
Sein Spektroskop zeigte die Anwesenheit von Stickstoff, Argon und einem weiteren Gas an. Ramsay vermutete, dass es sich um Helium handeln könnte, da es eine D3-Linie zu geben schien. (8) Da er wusste, dass Lockyer und William Crookes ein besseres Spektroskop hatten als er, schickte er ihnen eine Gasprobe. Leider war die Probe nicht geeignet, also besorgte Lockyer eine Uranitprobe, extrahierte das Gas und untersuchte es mit dem Spektroskop. Er schreibt: (8)
„Eine nach der anderen wurden die unbekannten Linien, die ich 1868 in der Sonne beobachtet hatte, dem Gas zugeordnet.“
Das Spektrum des Gases war identisch mit dem „Helium“ der Sonne. Ein neues Element eroberte sich seinen Platz im Periodensystem.
Besuche Chemicool’s Cool Helium Facts Page.

Aussehen und Eigenschaften
Schädliche Auswirkungen:
Helium ist nicht als giftig bekannt.
Eigenschaften:
Helium ist ein leichtes, geruchloses, farbloses, inertes, einatomiges Gas. Es kann zweiatomige Moleküle bilden, aber nur schwach und bei Temperaturen nahe dem absoluten Nullpunkt.
Helium hat den niedrigsten Schmelzpunkt aller Elemente und sein Siedepunkt liegt nahe dem absoluten Nullpunkt.
Im Gegensatz zu allen anderen Elementen erstarrt Helium nicht, sondern bleibt unter gewöhnlichem Druck bis zum absoluten Nullpunkt (0 K) flüssig.
Die Stimme von jemandem, der Helium eingeatmet hat, klingt vorübergehend hoch.
Verwendung von Helium
Die Magnetresonanztomographie (MRT) ist der größte Nutzer von Helium. Das Helium wird zur Kühlung der supraleitenden Magneten der MRT-Scanner verwendet.
Helium wird zum Füllen von Ballons (Zeppelinen) und zur Druckbeaufschlagung von Flüssigtreibstoffraketen verwendet.
Gemische aus Helium und Sauerstoff werden als künstliche „Luft“ für Taucher und andere unter Druck arbeitende Personen verwendet. Helium wird anstelle des Stickstoffs in normaler Luft verwendet, weil Helium nach einem langen Tauchgang den Körper schneller verlässt als Stickstoff, was eine schnellere Dekompression ermöglicht.
Helium wird als Schutzgas in der Nähe von Lichtbogenschweißungen verwendet, um z. B. die Reaktion von heißen Metallschweißnähten mit Sauerstoff zu verhindern. Das Gas wird in der Halbleiterindustrie verwendet, um eine inerte Atmosphäre für die Züchtung von Silizium- und Germaniumkristallen zu schaffen. Es wird auch als Hochtemperaturgas bei der Herstellung von Titan und Zirkonium und als Trägergas in der Gaschromatographie verwendet.
Häufigkeit und Isotope
Häufigkeit Erdkruste: 8 Teile pro Milliarde nach Gewicht, 43 Teile pro Milliarde nach Mol
Häufigkeit Sonnensystem: 23 % nach Gewicht, 7,4 % nach Mol
Kosten, rein: 5,2 $ pro 100g
Kosten, lose: $ pro 100g
Quelle: Fast das gesamte Helium auf der Erde ist das Ergebnis von radioaktivem Zerfall. Die Hauptquellen für Helium sind Erdgasvorkommen in Bohrlöchern in Texas, Oklahoma und Kansas. Helium wird durch fraktionierte Destillation des Erdgases, das bis zu 7 % Helium enthält, extrahiert.
Isotope: Helium hat 8 Isotope, deren Halbwertszeiten bekannt sind, mit den Massenzahlen 3 bis 10. Natürlich vorkommendes Helium ist ein Gemisch seiner beiden stabilen Isotope 3He und 4He mit natürlichen Häufigkeiten von 0,0001 % bzw. 99,999 %.

- Auguste Comte, Cours de Philosophie Positive bei Project Gutenberg
- Keith J. Laidler, The World of Physical Chemistry, 1993, S. 179.
- Die Ära der klassischen Spektroskopie, von MIT Spectroscopy.
- Gerard G. Emch, Mathematical and Conceptual Foundations of 20th-Century Physics, 1984, Elsevier Science Publishers, p211
- Helge Kragh, The Solar Element: A Reconsideration of Helium’s Early History, 2009, Annals of Science, 66:2, p157-182.
- J. Norman Lockyer, The Growth of our Knowledge of Helium, Science Progress, 1896, Vol. 5, p249
- W. Thomson, Presidential Address, British Association for the Advancement of Science, 1871, (Address. XCIX).
- Sir Norman Lockyer, The Sun’s Place in Nature., 1897, p47-48
Zitieren Sie diese Seite
Für eine Online-Verknüpfung kopieren Sie bitte eine der folgenden Möglichkeiten:
<a href="https://www.chemicool.com/elements/helium.html">Helium</a>
oder
<a href="https://www.chemicool.com/elements/helium.html">Helium Element Facts</a>
Um diese Seite in einem akademischen Dokument zu zitieren, verwenden Sie bitte die folgende MLA-konforme Zitierweise:
"Helium." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/helium.html>.