Generischer Name: Natriumpolystyrolsulfonat
Dosierungsform: oral / rektale Suspension
Medically reviewed by Drugs.com. Last updated on Jul 22, 2020.
- Übersicht
- Nebenwirkungen
- Dosierung
- Anwendung
- Interaktionen
- Mehr
- Indikationen und Anwendung für Kionex
- Kionex Dosierung und Anwendung
- Allgemeine Hinweise
- Empfohlene Dosierung
- Zubereitung und Verabreichung
- Dosierungsformen und Stärken
- Kontraindikationen
- Warnhinweise und Vorsichtsmaßnahmen
- Intestinale Nekrose
- Elektrolytstörungen
- Flüssigkeitsüberladung bei Patienten, die empfindlich auf eine hohe Natriumzufuhr reagieren
- Aspirationsgefahr
- Bindung an andere oral verabreichte Arzneimittel
- Nebenwirkungen
- Arzneimittelwechselwirkungen
- Allgemeine Wechselwirkungen
- Kationenspendende Antazida
- Sorbitol
- VERWENDUNG IN BESONDEREN POPULATIONEN
- Schwangerschaft
- Stillen
- Pädiatrische Anwendung
- Überdosierung
- Kionex Beschreibung
- Kionex – Klinische Pharmakologie
- Wirkmechanismus
- Pharmakodynamik
- Pharmakokinetik
- Nichtklinische Toxikologie
- Kanzerogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
- Lagerung und Handhabung
- Patientenhinweise
- PACKUNG/Etikettierung
- Mehr über Kionex (Natriumpolystyrolsulfonat)
- Ressourcen für Verbraucher
- Fachinformationen
- Verwandte Behandlungsrichtlinien
Indikationen und Anwendung für Kionex
Kionexis ist indiziert für die Behandlung von Hyperkaliämie.
Einschränkung der Anwendung:
Kionex sollte wegen seines verzögerten Wirkungseintritts nicht als Notfallbehandlung bei lebensbedrohlicher Hyperkaliämie eingesetzt werden.
Kionex Dosierung und Anwendung
Allgemeine Hinweise
Verabreichen Sie Kionex mindestens 3 Stunden vor oder 3 Stunden nach anderen oralen Medikamenten. Bei Patienten mit Gastroparese kann ein Abstand von 6 Stunden erforderlich sein
Empfohlene Dosierung
Die Intensität und Dauer der Therapie hängen vom Schweregrad und der Resistenz der Hyperkaliämie ab.
Oral
Die durchschnittliche Tagesgesamtdosis von Kionex für Erwachsene beträgt 15 g bis 60 g, verabreicht als 15-g-Dosis (vier gestrichene Teelöffel), ein- bis viermal täglich.
Rektal
Die durchschnittliche Dosis für Erwachsene beträgt 30 g bis 50 g alle sechs Stunden.
Zubereitung und Verabreichung
Suspension frisch zubereiten und innerhalb von 24 Stunden verwenden.
Kionex nicht erhitzen, da dies die Austauscheigenschaften des Harzes verändern könnte.
Ein gestrichener Teelöffel enthält etwa 3,5 g Kionex und 15 mEq Natrium.
Orale Suspension
Suspendieren Sie jede Dosis in einer kleinen Menge Wasser oder Sirup, etwa 3 bis 4 ml Flüssigkeit pro Gramm Harz.
Einlauf
Nach einem anfänglichen Reinigungseinlauf wird ein weicher, großer (28er) Gummischlauch über eine Strecke von etwa 20 cm in das Rektum eingeführt, wobei die Spitze weit in das Colon sigmoideum hineinragt, und mit Klebeband fixiert.
Die Verabreichung erfolgt als warme (Körpertemperatur) Emulsion in 100 ml wässrigem Träger und wird mit 50 bis 100 ml Flüssigkeit gespült. Es kann auch eine etwas dickere Suspension verwendet werden, die jedoch nicht zu einer Paste verarbeitet werden darf.
Die Emulsion sollte während der Verabreichung leicht gerührt werden. Das Harz sollte so lange wie möglich aufbewahrt werden, und es sollte ein Reinigungseinlauf mit einer nicht-natriumhaltigen Lösung folgen. Stellen Sie sicher, dass ein ausreichendes Volumen an Reinigungslösung (bis zu 2 Liter) verwendet wird.
Dosierungsformen und Stärken
Kionex ist ein cremefarbenes bis hellbraunes, fein gemahlenes Pulver und ist in 454 g-Dosen erhältlich.
Kontraindikationen
Kionex ist kontraindiziert bei Patienten mit den folgenden Erkrankungen:
– Überempfindlichkeit gegen Polystyrolsulfonatharze – Obstruktive Darmerkrankungen – Neugeborene mit eingeschränkter Darmmotilität
Warnhinweise und Vorsichtsmaßnahmen
Intestinale Nekrose
Fälle von intestinalen Nekrosen, einige mit tödlichem Ausgang, und andere schwerwiegende gastrointestinale unerwünschte Ereignisse (Blutungen, ischämische Kolitis, Perforation) wurden im Zusammenhang mit der Anwendung von Kionex berichtet. In den meisten dieser Fälle wurde über die gleichzeitige Anwendung von Sorbitol berichtet. In vielen dieser Fälle lagen Risikofaktoren für gastrointestinale Nebenwirkungen vor, darunter Frühgeburtlichkeit, Darmerkrankungen oder -operationen in der Vorgeschichte, Hypovolämie sowie Niereninsuffizienz und -versagen. Die gleichzeitige Verabreichung von Sorbitol wird nicht empfohlen.
– Nur bei Patienten mit normaler Darmfunktion anwenden. Vermeiden Sie die Anwendung bei Patienten, die nach einer Operation keinen Stuhlgang hatten. – Vermeiden Sie die Anwendung bei Patienten, bei denen das Risiko besteht, dass sie eine Verstopfung oder Impaktion entwickeln (einschließlich Patienten mit einer Vorgeschichte von Impaktion, chronischer Verstopfung, entzündlichen Darmerkrankungen, ischämischer Kolitis, vaskulärer intestinaler Atherosklerose, früherer Darmresektion oder Darmverschluss). Bei Patienten, die Verstopfung entwickeln, ist die Einnahme abzubrechen.
Elektrolytstörungen
Überwachen Sie während der Therapie das Serumkalium, da eine schwere Hypokaliämie auftreten kann.
Kionex ist nicht vollständig selektiv für Kalium, und kleine Mengen anderer Kationen wie Magnesium und Calcium können während der Behandlung ebenfalls verloren gehen. Überwachen Sie Kalzium und Magnesium bei Patienten, die Kionex erhalten.
Flüssigkeitsüberladung bei Patienten, die empfindlich auf eine hohe Natriumzufuhr reagieren
Jede 15 g-Dosis von Kionex enthält 1500 mg (60 mEq) Natrium. Überwachen Sie Patienten, die empfindlich auf die Natriumzufuhr reagieren (Herzinsuffizienz, Bluthochdruck, Ödeme) auf Anzeichen einer Flüssigkeitsüberladung. Eine Anpassung anderer Natriumquellen kann erforderlich sein.
Aspirationsgefahr
Fälle von akuter Bronchitis oder Bronchopneumonie, die durch die Inhalation von Natriumpolystyrolsulfonat-Partikeln verursacht wurden, sind berichtet worden. Patienten mit beeinträchtigtem Würgereflex, verändertem Bewusstseinszustand oder Patienten, die zu Regurgitation neigen, können einem erhöhten Risiko ausgesetzt sein. Verabreichen Sie Kionex in aufrechter Position.
Bindung an andere oral verabreichte Arzneimittel
Kionex kann oral verabreichte Arzneimittel binden, was deren gastrointestinale Absorption verringern und zu einer verminderten Wirksamkeit führen kann. Verabreichen Sie andere orale Arzneimittel mindestens 3 Stunden vor oder 3 Stunden nach Kionex. Bei Patienten mit Gastroparese kann ein Abstand von 6 Stunden erforderlich sein.
Nebenwirkungen
Die folgenden Nebenwirkungen werden an anderer Stelle in der Fachinformation beschrieben:
– Intestinale Nekrose – Elektrolytstörungen – Aspiration
Die folgenden unerwünschten Wirkungen wurden während der Anwendung von Kionex nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population von ungewisser Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Gastrointestinal: Anorexie, Verstopfung, Diarrhöe, fäkale Impaktion, gastrointestinale Konkremente (Bezoare), ischämische Kolitis, Übelkeit, Ulzerationen, Erbrechen, Magenreizung, Darmverschluss (aufgrund der Konzentration von Aluminiumhydroxid)
Metabolisch: Systemische Alkalose
Arzneimittelwechselwirkungen
Allgemeine Wechselwirkungen
Es wurden keine formellen Arzneimittelwechselwirkungsstudien am Menschen durchgeführt.
Kionex hat das Potenzial, andere Arzneimittel zu binden. In In-vitro-Bindungsstudien wurde gezeigt, dass Kionex die getesteten oralen Arzneimittel (n=6) signifikant bindet. Bei gleichzeitiger Verabreichung von Kionex wurde auch über eine verringerte Absorption von Lithium und Thyroxin berichtet. Die Bindung von Kionex an andere orale Arzneimittel könnte zu einer verminderten gastrointestinalen Absorption und einem Verlust der Wirksamkeit führen, wenn die Einnahme zeitnah zur Verabreichung von Kionex erfolgt. Verabreichen Sie Kionex mindestens 3 Stunden vor oder 3 Stunden nach anderen oralen Arzneimitteln. Bei Patienten mit Gastroparese kann ein Abstand von 6 Stunden erforderlich sein. Überwachen Sie das klinische Ansprechen und/oder die Blutspiegel, wenn möglich.
Kationenspendende Antazida
Die gleichzeitige orale Verabreichung von Kionex mit nicht resorbierbaren kationenspendenden Antazida und Abführmitteln kann die Kaliumaustauschfähigkeit des Harzes verringern und das Risiko einer systemischen Alkalose erhöhen.
Sorbitol
Sorbitol kann zum Risiko einer Darmnekrose beitragen und die gleichzeitige Anwendung wird nicht empfohlen.
VERWENDUNG IN BESONDEREN POPULATIONEN
Schwangerschaft
Risikozusammenfassung
Kionex wird nach oraler oder rektaler Verabreichung nicht systemisch resorbiert und es ist nicht zu erwarten, dass die mütterliche Anwendung zu einem fetalen Risiko führt.
Stillen
Zusammenfassung der Risiken
Kionex wird von der Mutter nicht systemisch resorbiert, so dass in der Stillzeit kein Risiko für den Säugling zu erwarten ist.
Pädiatrische Anwendung
Studien zur Sicherheit und Wirksamkeit wurden bei pädiatrischen Patienten nicht durchgeführt.
Bei pädiatrischen Patienten wird erwartet, dass Kionex wie bei Erwachsenen Kalium im praktischen Austauschverhältnis von 1 mEq Kalium pro 1 Gramm Harz bindet.
Bei Neugeborenen sollte Kionex nicht oral verabreicht werden. Sowohl bei Kindern als auch bei Neugeborenen kann eine übermäßige Dosierung oder unzureichende Verdünnung zu einer Impaktion des Harzes führen. Frühgeborene oder Säuglinge mit niedrigem Geburtsgewicht können ein erhöhtes Risiko für gastrointestinale Nebenwirkungen bei der Anwendung von Kionex haben.
Überdosierung
Eine Überdosierung kann zu Elektrolytstörungen einschließlich Hypokaliämie, Hypokalzämie und Hypomagnesiämie führen. Geeignete Maßnahmen sollten ergriffen werden, um die Serumelektrolyte (Kalium, Kalzium, Magnesium) zu korrigieren, und das Harz sollte durch geeignete Verwendung von Abführmitteln oder Einläufen aus dem Verdauungstrakt entfernt werden.
Kionex Beschreibung
Kionex ist ein Benzol, Diethenyl-Polymer, mit Ethenylbenzol, sulfoniert, Natriumsalz und hat die folgende Strukturformel:
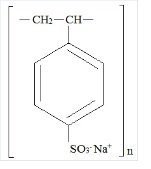
Das Arzneimittel ist eine cremefarbene bis hellbraune, fein gemahlene, pulverisierte Form von Natriumpolystyrolsulfonat, einem Kationenaustauscherharz, das in der Natriumphase mit einer In-vitro-Austauschkapazität von etwa 3.1 mEq (in vivo etwa 1 mEq) Kalium pro Gramm. Der Natriumgehalt beträgt etwa 100 mg (4,1 mEq) pro Gramm des Arzneimittels. Es kann oral oder rektal als Einlauf verabreicht werden.
Ein Gramm Kionex enthält 4,1 mEq Natrium.
Kionex – Klinische Pharmakologie
Wirkmechanismus
Kionex ist ein nicht absorbiertes Kationenaustauschpolymer, das ein Natrium-Gegenion enthält.
Kionex erhöht die fäkale Kaliumausscheidung durch Bindung von Kalium im Lumen des Gastrointestinaltrakts. Die Bindung von Kalium verringert die Konzentration von freiem Kalium im Magen-Darm-Lumen, was zu einer Verringerung des Serumkaliumspiegels führt. Das praktische Austauschverhältnis beträgt 1 mEq K pro 1 Gramm Harz.
Während das Harz den Darm passiert oder nach Verabreichung durch einen Einlauf im Dickdarm verbleibt, werden die Natriumionen teilweise freigesetzt und durch Kaliumionen ersetzt. Dieser Vorgang findet hauptsächlich im Dickdarm statt, der Kaliumionen in höherem Maße ausscheidet als der Dünndarm. Die Effizienz dieses Prozesses ist begrenzt und unvorhersehbar variabel.
Pharmakodynamik
Die effektive Senkung des Serumkaliums mit Kionex kann Stunden bis Tage dauern.
Pharmakokinetik
Die In-vivo-Effizienz von Natrium-Kalium-Austauscherharzen liegt bei etwa 33 Prozent; daher wird etwa ein Drittel des tatsächlichen Natriumgehalts des Harzes an den Körper abgegeben.
Kionex wird nicht systemisch resorbiert.
Arzneimittelinteraktionen
In-vitro-Bindungsstudien zeigten, dass Kionex signifikant an die folgenden getesteten Arzneimittel – Warfarin, Metoprolol, Phenytoin, Furosemid, Amlodipin und Amoxicillin – bindet.
Nichtklinische Toxikologie
Kanzerogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Studien wurden nicht durchgeführt.
Lagerung und Handhabung
Kionex ist als cremefarbenes bis hellbraunes, fein gemahlenes Pulver in Gläsern zu 1 Pfund (454 g) erhältlich, NDC 0574-2004-16.
Lagerung bei 20° bis 25°C (68° bis 77°F).
Patientenhinweise
Wechselwirkungen mit anderen Arzneimitteln
Beraten Sie Patienten, die andere orale Medikamente einnehmen, die Einnahme von Kionex um mindestens 3 Stunden zu verschieben (vor oder nach der Einnahme)
Nur auf Rezept
Verpackt von
Perrigo
Minneapolis, MN 55427
Revised 08/2017
PACKUNG/Etikettierung
Rx Only
NDC 0574-2004-16
Kionex®
Natriumpolystyrolsulfonat zur Suspension
ERWACHSENEN-DOSIERUNG: 15 g (etwa 4 gestrichene Teelöffel) ein- bis viermal täglich in Wasser. Siehe vollständige Gebrauchsinformation.
Die Wirkung muss durch häufige Serum-Kalium-Bestimmungen innerhalb von 24 Stunden sorgfältig kontrolliert werden. Der Natriumgehalt beträgt etwa 60 mEq pro 15 g.
Die Suspension sollte frisch zubereitet und nicht länger als 24 Stunden gelagert werden. In dichten, lichtbeständigen Behältern, wie in der USP definiert, abfüllen.
Lagerung: Bei 20° bis 25°C (68° bis 77°F) lagern.
Packungsbeilage lesen.
454 Gramm (1 LB)
| Kionex Natriumpolystyrolsulfonat Pulver, zur Suspension |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Etikettierer -. Paddock Laboratories, LLC (967694121)
Mehr über Kionex (Natriumpolystyrolsulfonat)
- Nebenwirkungen
- Während der Schwangerschaft oder Stillzeit
- Dosierungshinweise
- Medikamentöse Wechselwirkungen
- En Español
- 4 Bewertungen
- Medikamentenklasse: Kationenaustauscherharze
- FDA-Warnungen (2)
Ressourcen für Verbraucher
- Patienteninformationen
- Kionex (Erweiterte Lektüre)
Fachinformationen
- Verschreibungsinformationen
- Natriumpolystyrolsulfonat zum Einnehmen (FDA)
Andere Marken Kayexalate, Kalexate
Verwandte Behandlungsrichtlinien
- Hyperkaliämie
Medizinischer Haftungsausschluss