
Brønsted in seinem Labor
Nach dem Brønsted-Lowry-Konzept wird der Prozess, der früher als einfache Dissoziation einer generischen Säure HA (HA → H+ + A-) geschrieben wurde, korrekter als Protonentransferprozess betrachtet:
HA + H2O → A-+ H3O+(3-1)
Die Idee ist wiederum, dass das Proton, sobald es die Säure verlässt, an etwas gebunden sein muss (was wir als Base bezeichnen); es kann nicht einfach als freies Wasserstoffion herumschwimmen.
- Konjugierte Säure-Base-Paare
- Starke Säuren und schwache Säuren
- Definition einer „starken“ Säure
- Der Nivellierungseffekt
- Schwache Säuren
- Starke Säuren haben schwache konjugierte Basen
- Salze schwacher Säuren lösen sich zu alkalischen Lösungen auf
- Die einzigen gebräuchlichen starken Basen sind Hydroxide der Gruppe 1
- Salze schwacher Basen ergeben saure Lösungen
- Autoprotolyse
- Ampholyten
- Das Karbonat-Säure-Basen-System
Konjugierte Säure-Base-Paare
Eine Reaktion einer Säure mit einer Base ist also eine Protonenaustauschreaktion; Wenn die Säure mit AH und die Base mit B bezeichnet wird, können wir eine verallgemeinerte Säure-Base-Reaktion schreiben als
AH + B → A- + BH+(3-2)
Beachte, dass die Umkehrung dieser Reaktion,
BH+ + A- → B + AH(3-3)
ebenfalls eine Säure-Base-Reaktion ist. Da Protonenübertragungsreaktionen reversibel sind, folgt daraus, dass die Übertragung eines Protons von einer Säure auf eine Base notwendigerweise ein neues Speziespaar erzeugen muss, das zumindest im Prinzip ein eigenes Säure-Base-Paar bilden kann, das wir als konjugiertes Säure-Base-Paar bezeichnen:
Der Begriff konjugiert bedeutet „verbunden mit“, was impliziert, dass die Mitglieder eines konjugierten Paares durch die Anwesenheit oder Abwesenheit eines Protons „verbunden“ sind.
Welche Spezies als „konjugiert“ gelten, hängt von der Richtung ab, in der die Reaktion geschrieben wird, wie im Folgenden für den Protonentransfer von (3-1) gezeigt wird:


Auch für die verallgemeinerten Protonentransfers (3-2) und (3-3) gilt


Die folgende Tabelle zeigt die konjugierten Paare einer Reihe typischer Säure-Base-Systeme.
| Säure | Base | ||
| Salzsäure | HCl | Chloridion | Cl- |
| Essigsäure | CH3CH2COOH | Acetat-Ion | CH3CH2COO- |
| Nitronensäure | HNO3 | Nitrat-Ion | NO3- |
| Dihydrogenphosphat-Ion | H2PO4- | Monohydrogenphosphat-Ion | HPO42- |
| Wasserstoffsulfat-Ion | HSO4- | Sulfat-Ion | SO42- |
| Wasserstoff Carbonat („Bicarbonat“) Ion | HCO3- | Carbonat Ion | CO32- |
| Ammonium Ion | NH4+ | Ammoniak | NH3 |
| Eisen(III)-Ion | Fe(H2O)63+ | pentaaquoironIII | Fe(H2O)5OH2+ |
| Wasser | H2O | Hydroxidion | OH- |
| Hydroniumion | H3O+ | Wasser | H2O |
Starke Säuren und schwache Säuren
Wir können die generalisierte Säure-.Basenreaktion
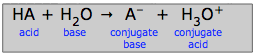
als einen Wettbewerb zweier Basen um ein Proton betrachten:

Definition einer „starken“ Säure
Wenn die Base H2O dieses Tauziehen mit überwältigender Mehrheit gewinnt, dann wird die Säure HA als eine starke Säure bezeichnet. Dies ist der Fall bei Salzsäure und den anderen gebräuchlichen starken „Mineralsäuren“ H2SO4, HNO3 und HClO4:
Lösungen dieser Säuren in Wasser sind in Wirklichkeit Lösungen der rechts fett gedruckten ionischen Spezies. Daraus folgt, dass das, was wir z.B. als 1 M Lösung von „Salzsäure“ in Wasser bezeichnen, in Wirklichkeit gar keine nennenswerte Konzentration von HCl enthält; die einzige wirklich vorhandene Säure in einer solchen Lösung ist H3O+!
Aus diesen Überlegungen ergeben sich zwei wichtige Regeln, die man nicht nur kennen, sondern auch verstehen muss:
H3O+ ist die stärkste Säure, die in Wasser vorkommen kann;
Alle starken Säuren scheinen in Wasser gleich stark zu sein.
Der Nivellierungseffekt
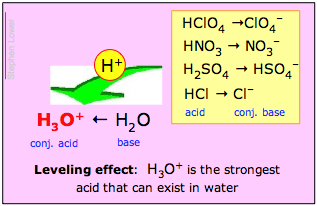
Die zweite dieser Aussagen wird als Nivellierungseffekt bezeichnet. Er besagt, dass die starken Säuren, obwohl sie unterschiedliche Protonendonorstärken haben, in Wasser vollständig dissoziiert sind. Chemiker sagen, dass ihre Stärken durch das Lösungsmittel Wasser „nivelliert“ werden.
Ein vergleichbarer Effekt wäre zu beobachten, wenn man versuchen würde, die Stärken mehrerer Erwachsener zu beurteilen, indem man eine Reihe von Tauziehwettbewerben mit einem kleinen Kind durchführt. Man würde erwarten, dass die Erwachsenen bei jedem Versuch mit überwältigender Mehrheit gewinnen würden; ihre Stärken wären durch die des Kindes „nivelliert“ worden.
Schwache Säuren
Die meisten Säuren sind jedoch in der Lage, ihre Protonen fester zu halten, so dass nur ein kleiner Teil der Säure dissoziiert wird. So ist Blausäure, HCN, in Wasser eine schwache Säure, weil das Proton die einsamen Elektronenpaare des Cyanid-Ions CN- besser teilen kann als die von H2O, so dass die Reaktion
HCN + H2O → H3O+ + CN-
nur zu einem sehr geringen Teil abläuft.
Da eine starke Säure ihr Proton nur schwach, eine schwache Säure aber fest bindet, kann man sagen:
Starke Säuren sind „schwach“, schwache Säuren sind „stark“
Wenn du dieses scheinbare Paradoxon erklären kannst, hast du eine der wichtigsten Ideen der Säure-Basen-Chemie verstanden!
|
Reaktion
|
Säure
|
Base
|
Konjugat Säure
|
Konjugat Base
|
| 1) Autoionisation von Wasser H2O | H2O | H2O | H3O+ | OH- |
| 2) Ionisation von Blausäure HCN | HCN | H2O | H3O+ | CN- |
| 3) Ionisierung von Ammoniak NH3 in Wasser | NH3 | H2O | NH4+ | OH- |
| 4) Hydrolyse von Ammoniumchlorid NH4Cl | NH4+ | H2O | H3O+ | NH3 |
| 5) Hydrolyse von Natriumacetat CH3COO- Na+ | H2O | CH3COO- | CH3COOH | OH- |
| 6) Neutralisation von HCl durch NaOH | HCl | OH- | H2O | Cl- |
| 7) Neutralisation von NH3 durch Essigsäure | CH3COOH | NH3 | NH4+ | CH3COO- |
| 8) Auflösung von BiOCl (Bismut-Oxychlorid) durch HCl | 2 H3O+ | BiOCl | Bi(H2O)3+ | H2O, Cl- |
| 9) Zersetzung von Ag(NH3)2+ durch HNO3 | 2 H3O+ | Ag(NH3)2+ | NH4+ | H2O |
| 10) Verdrängung von HCN durch CH3COOH | CH3COOH | CN- | HCN | CH3COO- |
Starke Säuren haben schwache konjugierte Basen
Dies ist nur eine ReErklärung dessen, was in dem oben Gesagten über die Unterscheidung zwischen starken und schwachen Säuren implizit enthalten ist. Die Tatsache, dass HCl eine starke Säure ist, bedeutet, dass seine konjugierte Base Cl- eine zu schwache Base ist, um das Proton in Konkurrenz zu H2O oder H3O+ zu halten. In ähnlicher Weise bindet das CN–Ion stark an ein Proton, was HCN zu einer schwachen Säure macht.
Salze schwacher Säuren lösen sich zu alkalischen Lösungen auf
Die Tatsache, dass HCN eine schwache Säure ist, bedeutet, dass das Cyanid-Ion CN- leicht mit Protonen reagiert und somit eine relativ gute Base ist. Ein Beweis dafür ist, dass ein Salz wie KCN, wenn es in Wasser gelöst wird, eine leicht alkalische Lösung ergibt:
CN- + H2O → HCN + OH-
Diese Reaktion wird manchmal immer noch mit dem alten Namen Hydrolyse („Wasserspaltung“) bezeichnet, was zwar wörtlich korrekt ist, aber ihre Identität als eine weitere Säure-Base-Reaktion verschleiert. Reaktionen dieser Art finden nur in geringem Umfang statt; eine 0,1M Lösung von KCN ist für alle praktischen Zwecke immer noch 0,1M an Cyanidionen.
Die einzigen gebräuchlichen starken Basen sind Hydroxide der Gruppe 1
Die einzigen wirklich starken Basen, denen man in der Alltagschemie begegnet, sind Alkalimetallhydroxide wie NaOH und KOH, die im Wesentlichen Lösungen des Hydroxid-Ions (und natürlich des Kations) sind.)
Die meisten anderen Verbindungen, die Hydroxidionen enthalten, wie Fe(OH)3 und Ca(OH)2, sind in Wasser nicht ausreichend löslich, um stark alkalische Lösungen zu ergeben, so dass sie normalerweise nicht als starke Basen betrachtet werden.
Es gibt tatsächlich eine Reihe von Basen, die stärker sind als das Hydroxid-Ion – am bekanntesten sind das Oxid-Ion O2- und das Amid-Ion NH2-, die aber so stark sind, dass sie dem Wasser sogar ein Proton entziehen können:
O2- + H2O → 2 OH-
NH2- + H2O → NH3 + OH-
Daraus ergibt sich die gleiche Art von Nivellierungseffekt, den wir für Säuren beschrieben haben, mit der Folge, dass
Salze schwacher Basen ergeben saure Lösungen
Das häufigste Beispiel hierfür ist Ammoniumchlorid, NH4Cl, dessen wässrige Lösungen deutlich sauer sind:
NH4+ + H2O → NH3 + H3O+
Da diese (und ähnliche) Reaktionen nur in geringem Maße ablaufen, ist eine Lösung von Ammoniumchlorid nur schwach sauer.
Autoprotolyse
Aus einigen der oben genannten Beispiele, sehen wir, dass Wasser als Säure
CN- + H2O → HCN + OH-
und als Base
NH4+ + H2O → NH3 + H3O+
Wenn das so ist, dann gibt es keinen Grund, warum „Wasser-die-Säure“ nicht ein Proton an „Wasser-die-Base“ spenden kann:

Diese Reaktion wird als Autoprotolyse von Wasser bezeichnet.
Chemiker bezeichnen diese Reaktion immer noch häufig als „Dissoziation“ von Wasser und verwenden die Arrhenius-Gleichung H2O → H+ + OH- als eine Art Kurzformel.
Wie in der vorherigen Lektion besprochen, findet dieser Prozess nur in geringem Umfang statt. Er bedeutet jedoch, dass in jeder wässrigen Lösung sowohl Hydronium- als auch Hydroxidionen vorhanden sind.
Können auch andere Flüssigkeiten eine Autoprotolyse aufweisen? Die Antwort lautet: Ja. Das bekannteste Beispiel ist flüssiges Ammoniak:
2 NH3 → NH4+ + NH2-
Auch reine flüssige Schwefelsäure kann das Spiel mitspielen:
2 H2SO4→ H3SO4+ + HSO4-
Jedes dieser Lösungsmittel kann die Basis eines eigenen Säure-Base-„Systems“ sein, parallel zum bekannten „Wasser-System“.
Ampholyten
Wasser, das sowohl als Säure als auch als Base wirken kann, wird als amphiprotisch bezeichnet: es kann „in beide Richtungen schwingen“. Ein Stoff wie Wasser, der amphiprotisch ist, wird als Ampholyt bezeichnet.
Wie hier angedeutet, kann auch das Hydroxid-Ion ein Ampholyt sein, aber nicht in wässriger Lösung, in der das Oxid-Ion nicht existieren kann.
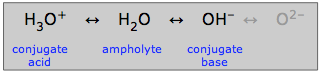
Es ist natürlich die amphiprotische Natur des Wassers, die es ihm erlaubt, seine besondere Rolle in der gewöhnlichen aquatischen Säure-Basen-Chemie zu spielen. Aber auch viele andere amphiprotische Substanzen können in wässrigen Lösungen vorkommen. Jede solche Substanz hat immer eine konjugierte Säure und eine konjugierte Base; wenn man also diese beiden Konjugate einer Substanz erkennen kann, weiß man, dass sie amphiprotisch ist.
Das Karbonat-Säure-Basen-System
Zum Beispiel stellt die Triplettreihe {Kohlensäure, Bikarbonation, Karbonation} eine amphiprotische Reihe dar, in der das Bikarbonation der Ampholyt ist, der sich von jedem seiner Nachbarn durch die Hinzufügung oder Entfernung eines Protons unterscheidet:
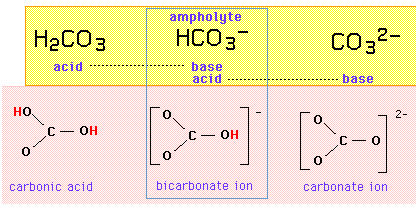
Wenn das Bicarbonat-Ion sowohl eine Säure als auch eine Base ist, sollte es in der Lage sein, ein Proton mit sich selbst in einer Autoprotolysereaktion auszutauschen:
HCO3- + HCO3- → H2CO3 + CO32-
Von dieser Reaktion hängt unser Leben ab! CO2, ein Nebenprodukt des Stoffwechsels in jeder Zelle Ihres Körpers, reagiert mit Wasser zu Kohlensäure
H2CO3, die, wenn sie sich ansammeln würde, Ihr Blut tödlich sauer machen würde. Das Blut enthält jedoch auch Karbonat-Ionen, die gemäß der Umkehrung der obigen Gleichung zu Bikarbonat reagieren, das vom Blut sicher in die Lunge transportiert werden kann. In der Lunge läuft die Autoprotolyse-Reaktion in Vorwärtsrichtung ab, wobei H2CO3 entsteht, das Wasser verliert und CO2 bildet, das mit der Atemluft ausgestoßen wird. Das Carbonat-Ion wird in das Blut zurückgeführt, um schließlich ein weiteres CO2-Molekül aufzunehmen.