Einige Atome sind polarer als andere, weil sie „gieriger“ nach Elektronen sind.
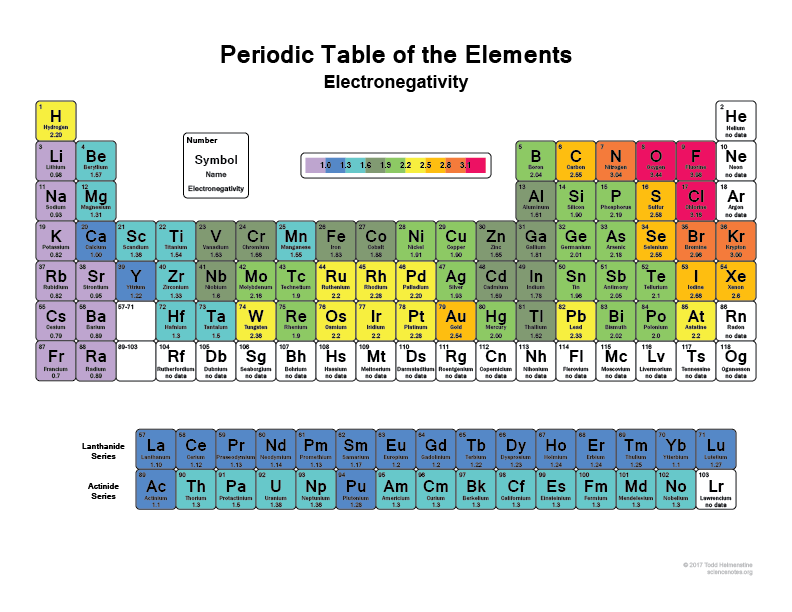
Schauen Sie sich Ihr Periodensystem an, je weiter Sie nach rechts und nach oben gehen, desto elektronegativer werden die Atome (ohne die Edelgase, weil sie volle Schalen haben und „glücklich“ sind und keine Valenzelektronen brauchen).
Ich denke, jeder hat schon einmal gehört, dass z.B. Fluor (F) eines der elektronegativsten Elemente ist, es reißt buchstäblich Elektronen aus Wasserstoff- oder Kohlenstoffatomen. Das Gleiche gilt für Chlor (Cl)
Sieh dir dieses Bild an:
Deshalb haben manche Moleküle bei einer Bindung superpolare Bereiche, weil sie etwas wie Wasserstoff mit etwas wie Mehl verbinden, das die meiste Zeit nur die Elektronen bei sich hat.
Diese Frage kann auch durch die Idee der Elektronenwolken und die Tatsache erklärt werden, dass elektronegativere Atome in der Regel mehr Elektronen haben, die die meiste Zeit bei ihnen bleiben, im Gegensatz zu weniger elektronegativen Atomen.

Dies nennt man das Dipolmoment und ohne zu sehr ins Detail zu gehen, sieht man, dass die meisten Elektronen näher am Sauerstoff als am Wasserstoff sind (weil Sauerstoff elektronegativer ist als Wasserstoff)
Das Wort elektronegativ klingt übrigens manchmal kontraintuitiv, aber es heißt elektro-negativ statt positiv, weil in der Chemie Atome, die Elektronen gewinnen, ein negatives Vorzeichen haben (Beispiel: #Cl^-# ist ein Chlor, das ein Elektron gewonnen hat).