Objetivos de aprendizaje
- Explicar por qué los puntos de ebullición de los alcoholes son mayores que los de los éteres y alcanos de masas molares similares.
- Explicar por qué los alcoholes y éteres de cuatro o menos átomos de carbono son solubles en agua mientras que los alcanos comparables no lo son.
Los alcoholes pueden considerarse derivados del agua (H2O; también se escribe HOH).

Al igual que el enlace H-O-H del agua, el enlace R-O-H está doblado y las moléculas de alcohol son polares. Esta relación es particularmente evidente en las moléculas pequeñas y se refleja en las propiedades físicas y químicas de los alcoholes de baja masa molar. La sustitución de un átomo de hidrógeno de un alcano por un grupo OH permite que las moléculas se asocien mediante enlaces de hidrógeno (Figura \(\PageIndex{1})).
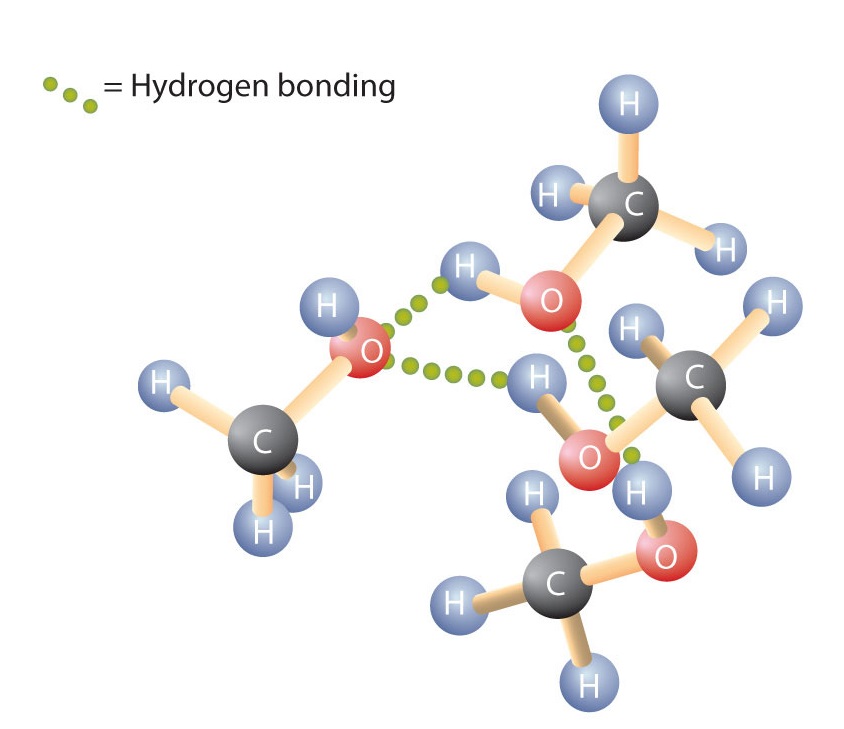
Recordemos que las propiedades físicas están determinadas en gran medida por el tipo de fuerzas intermoleculares. La tabla \(\PageIndex{1}) enumera las masas molares y los puntos de ebullición de algunos compuestos comunes. La tabla muestra que sustancias con masas molares similares pueden tener puntos de ebullición muy diferentes.
| Fórmula | Nombre | Masa polar | Punto de ebullición (°C) |
|---|---|---|---|
| CH4 | metano | 16 | -164 |
| HOH | agua | 18 | 100 |
| C2H6 | etano | 30 | -89 |
| CH3OH | metanol | 32 | 65 |
| C3H8 | propano | 44 | -42 |
| CH3CH2OH | etanol | 46 | 78 |
| C4H10 | butano | 58 | -1 |
| CH3CH2CH2OH | 1-propanol | 60 | 97 |
Los alcanos son no polares y, por tanto, se asocian sólo a través de fuerzas de dispersión relativamente débiles. Los alcanos con uno a cuatro átomos de carbono son gases a temperatura ambiente. En cambio, incluso el metanol (con un átomo de carbono) es un líquido a temperatura ambiente. El enlace de hidrógeno aumenta considerablemente los puntos de ebullición de los alcoholes en comparación con los hidrocarburos de masa molar comparable. El punto de ebullición es una medida aproximada de la cantidad de energía necesaria para separar una molécula líquida de sus vecinas más cercanas. Si las moléculas interactúan a través de enlaces de hidrógeno, se debe suministrar una cantidad relativamente grande de energía para romper esas atracciones intermoleculares. Sólo entonces puede la molécula escapar del líquido al estado gaseoso.
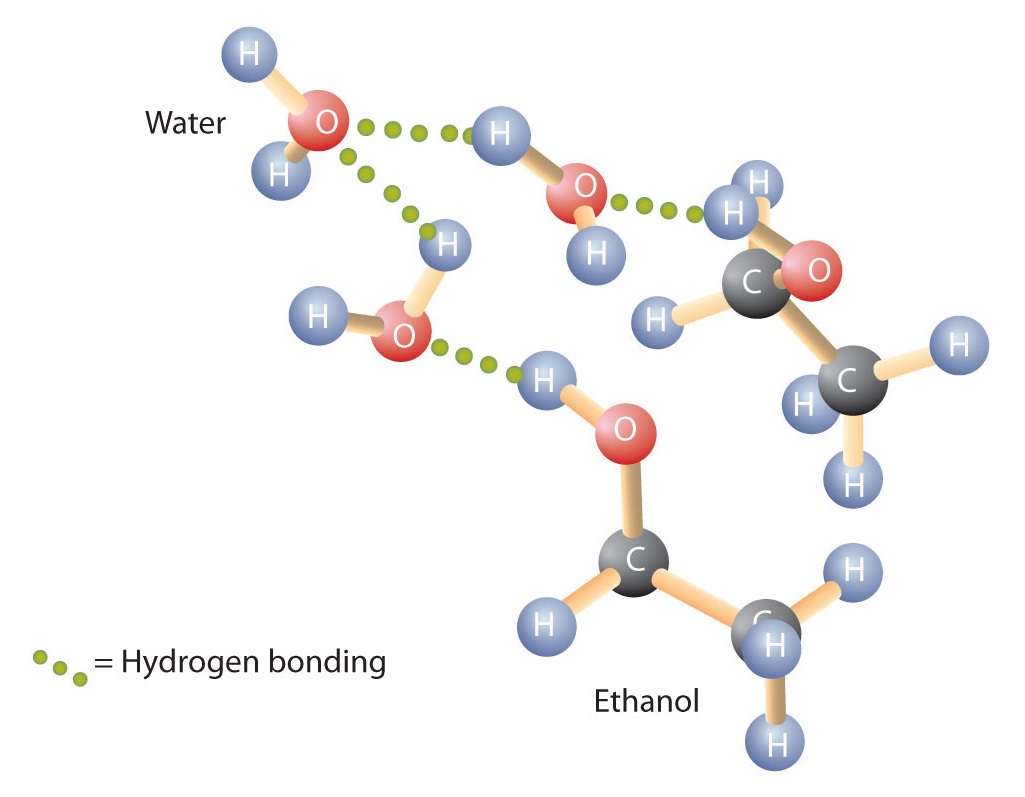
Los alcoholes también pueden participar en el enlace de hidrógeno con las moléculas de agua (Figura \(\PageIndex{2}\)). Así, mientras que los hidrocarburos son insolubles en agua, los alcoholes con uno a tres átomos de carbono son completamente solubles. Sin embargo, a medida que aumenta la longitud de la cadena, la solubilidad de los alcoholes en el agua disminuye; las moléculas se parecen más a los hidrocarburos y menos al agua. El alcohol 1-decanol (CH3CH2CH2CH2CH2CH2CH2OH) es esencialmente insoluble en agua. Frecuentemente encontramos que el límite de la solubilidad en una familia de compuestos orgánicos se produce en cuatro o cinco átomos de carbono.
Resumen
Los alcoholes tienen puntos de ebullición más altos que los éteres y alcanos de masas molares similares porque el grupo OH permite a las moléculas de alcohol participar en el enlace de hidrógeno. Los alcoholes de cuatro o menos átomos de carbono son solubles en agua porque las moléculas de alcohol participan en el enlace de hidrógeno con las moléculas de agua; las moléculas de alcanos comparables no pueden participar en el enlace de hidrógeno.
Ejercicios de repaso de conceptos
-
¿Por qué el etanol es más soluble en agua que el 1-hexanol?
-
¿Por qué el 1-butanol tiene un punto de ebullición más bajo que el 1-hexanol?
Respuestas
-
El etanol tiene un grupo OH y sólo 2 átomos de carbono; el 1-hexanol tiene un grupo OH por 6 átomos de carbono y, por tanto, se parece más a un hidrocarburo (no polar) que el etanol.
-
La masa molar del 1-hexanol es mayor que la del 1-butanol.
Ejercicios
Responde a los siguientes ejercicios sin consultar las tablas del texto.
-
Ordenar estos alcoholes en orden de punto de ebullición creciente: etanol, metanol y 1-propanol.
-
¿Cuál tiene mayor punto de ebullición: el butano o el 1-propanol?
-
Ordenar estos alcoholes por orden de solubilidad creciente en el agua: 1-butanol, metanol y 1-octanol.
-
Ordenar estos compuestos en orden de solubilidad creciente en el agua: 1-butanol, etanol y pentano.
Respuestas
-
metanol < etanol < 1-propanol
-
1-octanol < 1-butanol < metanol