Objetivos de aprendizaje
- Conocer la relación entre la fuerza del ácido o de la base y la magnitud de \(K_a\), \(K_b\), \(pK_a\), y \(pK_b\).
- Para entender el efecto de nivelación.
La magnitud de la constante de equilibrio para una reacción de ionización puede utilizarse para determinar las fuerzas relativas de ácidos y bases. Por ejemplo, la ecuación general para la ionización de un ácido débil en agua, donde HA es el ácido parental y A- es su base conjugada, es la siguiente:
\️
La constante de equilibrio para esta disociación es la siguiente:
{} \label{16.5.2}]
Como hemos señalado anteriormente, la concentración de agua es esencialmente constante para todas las reacciones en solución acuosa, por lo que \(\) en la ecuación \(\ref{16.5.2}\) puede incorporarse a una nueva cantidad, la constante de ionización del ácido (\(K_a\)), también llamada constante de disociación del ácido:
\=dfrac{}{} \label{16.5.3}]
Así, los valores numéricos de K y \(K_a\) difieren por la concentración de agua (55,3 M). Una vez más, para simplificar, \(H_3O^+\) se puede escribir como \(H^+\) en la ecuación \(\ref{16.5.3}\). Sin embargo, hay que tener en cuenta que el \Nh^+ libre no existe en las soluciones acuosas y que en todas las reacciones de ionización de los ácidos se transfiere un protón al \ H_2O para formar iones de hidronio, \ H_3O^+. Cuanto mayor sea la \ (K_a), más fuerte será el ácido y mayor será la concentración de \ (H^+\) en el equilibrio. Como todas las constantes de equilibrio, las constantes de ionización ácido-base se miden en realidad en términos de las actividades de \(H^+\) o \(OH^-\), por lo que no tienen unidad. Los valores de \(K_a\) para una serie de ácidos comunes se dan en la Tabla \(\PageIndex{1}).
Las bases débiles reaccionan con el agua para producir el ion hidróxido, como se muestra en la siguiente ecuación general, en la que B es la base madre y BH+ es su ácido conjugado:
\NLa constante de equilibrio para esta reacción es la constante de ionización de la base (Kb), también llamada constante de disociación de la base:
\N= \frac{}{} \label{16.5.5}]
Una vez más, la concentración de agua es constante, por lo que no aparece en la expresión de la constante de equilibrio; en cambio, se incluye en la \(K_b\). Cuanto mayor sea el \(K_b\), más fuerte será la base y mayor será la concentración de \(OH^-\) en el equilibrio. Los valores de \(K_b\) para un número de bases débiles comunes se dan en la Tabla \(\PageIndex{2}).
Hay una relación simple entre la magnitud de \(K_a\) para un ácido y \(K_b\) para su base conjugada. Consideremos, por ejemplo, la ionización del ácido cianhídrico (\(HCN\)) en el agua para producir una solución ácida, y la reacción de \(CN^-\) con el agua para producir una solución básica:
\
\
La expresión de la constante de equilibrio para la ionización del HCN es la siguiente:
\}{} \label{16.5.8}]
La expresión correspondiente para la reacción del cianuro con el agua es la siguiente:
{}
Si sumamos las ecuaciones \ref{16.5.6} y \ref{16.5.7), obtenemos lo siguiente:
| Reacción | Constantes de equilibrio |
|---|---|
| (|cancel{HCN_(aq)}} \H^+_(aq)}+cancel{CN^-_(aq)} | (K_a=cancelación/cancelación) |
| (cancelación{CN^-(aq)}+H_2O_(l)} \rightleftharpoons OH^-_{(aq)}+{cancel{HCN_{(aq)}}) | (K_b={cancel{}/{cancel{}}) |
| (H_2O_(l)} \N – H^+_(aq)}+OH^-_(aq)}) | (K=K_a \N – K_b=) |
En este caso, la suma de las reacciones descritas por \(K_a) y \(K_b) es la ecuación de la autoionización del agua, y el producto de las dos constantes de equilibrio es \(K_w\):
\
Por tanto, si conocemos \(K_a\) para un ácido o \(K_b\) para su base conjugada, podemos calcular la otra constante de equilibrio para cualquier par ácido-base conjugado.
Al igual que con \(pH\), \(pOH\), y pKw, podemos utilizar logaritmos negativos para evitar la notación exponencial en la escritura de las constantes de ionización de ácidos y bases, definiendo \(pK_a\) como sigue:
\
\
y \(pK_b\) como
\
\
Similarmente, la ecuación \(\ref{16.5.10}\), que expresa la relación entre \(K_a) y \(K_b\), puede escribirse en forma logarítmica como sigue
\
A 25 °C, esto se convierte en
\
Los valores de \(pK_a\) y \(pK_b\) se dan para varios ácidos y bases comunes en las tablas \(\PageIndex{1}\) y \(\PageIndex{2}\), respectivamente, y en las Tablas E1 y E2 se ofrece un conjunto más amplio de datos. Debido al uso de logaritmos negativos, los valores más pequeños de \(pK_a\) corresponden a constantes de ionización de ácidos más grandes y, por lo tanto, a ácidos más fuertes. Por ejemplo, el ácido nitroso (\(HNO_2\)), con un \(pK_a\) de 3,25, es un ácido aproximadamente un millón de veces más fuerte que el ácido cianhídrico (HCN), con un \(pK_a\) de 9,21. A la inversa, los valores más pequeños de \(pK_b\) corresponden a constantes de ionización de bases más grandes y, por lo tanto, a bases más fuertes.
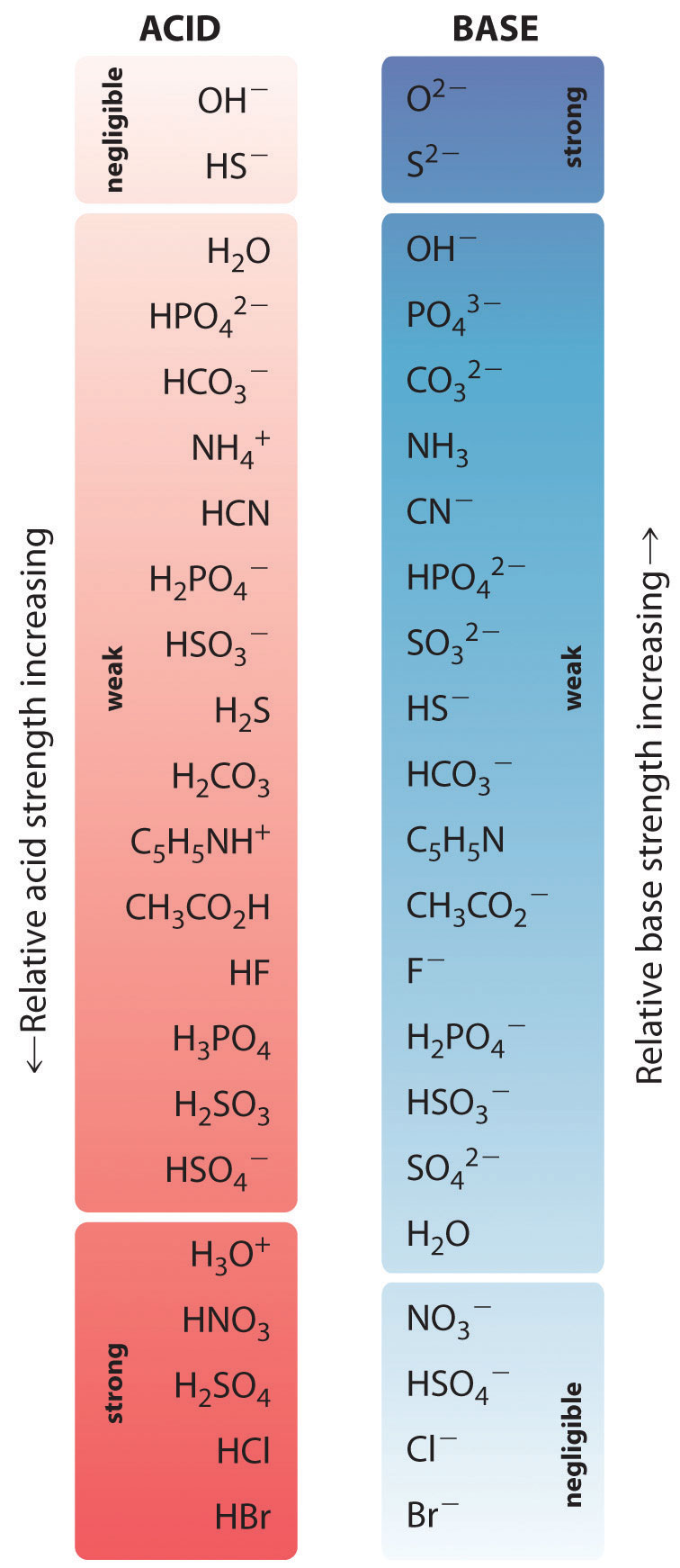
Las fuerzas relativas de algunos ácidos comunes y sus bases conjugadas se muestran gráficamente en la Figura \(\PageIndex{1}\). Los pares ácido-base conjugados se enumeran en orden (de arriba a abajo) de aumento de la fuerza del ácido, que corresponde a los valores decrecientes de \(pK_a\). Este orden corresponde a una fuerza decreciente de la base conjugada o a valores crecientes de \(pK_b\). En la parte inferior izquierda de la figura \(\PageIndex{2}) están los ácidos fuertes más comunes; en la parte superior derecha están las bases fuertes más comunes. Obsérvese la relación inversa entre la fuerza del ácido principal y la fuerza de la base conjugada. Así, la base conjugada de un ácido fuerte es una base muy débil, y la base conjugada de un ácido muy débil es una base fuerte.
La base conjugada de un ácido fuerte es una base débil y viceversa.
Podemos utilizar las fuerzas relativas de los ácidos y las bases para predecir la dirección de una reacción ácido-base siguiendo una única regla: un equilibrio ácido-base siempre favorece al lado con el ácido y la base más débiles, como indican estas flechas:
En una reacción ácido-base, el protón siempre reacciona con la base más fuerte.
Por ejemplo, el ácido clorhídrico es un ácido fuerte que se ioniza esencialmente por completo en una solución acuosa diluida para producir \(H_3O^+\) y \(Cl^-\); sólo cantidades insignificantes de moléculas \(HCl\) quedan sin disociar. Por lo tanto, el equilibrio de ionización se encuentra prácticamente a la derecha, como se representa con una sola flecha:
\
En cambio, el ácido acético es un ácido débil, y el agua es una base débil. En consecuencia, las soluciones acuosas de ácido acético contienen mayoritariamente moléculas de ácido acético en equilibrio con una pequeña concentración de \(H_3O^+\) e iones de acetato, y el equilibrio de ionización se encuentra muy a la izquierda, como se representa con estas flechas:
\
De forma similar, en la reacción del amoníaco con el agua, el ion hidróxido es una base fuerte, y el amoníaco es una base débil, mientras que el ion amonio es un ácido más fuerte que el agua. Por lo tanto, este equilibrio también se encuentra a la izquierda:
\Nde la base
Todos los equilibrios ácido-base favorecen al lado del ácido y la base más débiles. Así, el protón se une a la base más fuerte.
Ejemplo \(\PageIndex{1}): Iones butirato y dimetilamonio
- Calcular \(K_b\) y \(pK_b\) del ion butirato (\(CH_3CH_2CH_2CO_2^-\)). El \(pK_a\) del ácido butírico a 25°C es de 4,83. El ácido butírico es el responsable del mal olor de la mantequilla rancia.
- Calcule \(K_a\) y \(pK_a\) del ion dimetilamonio (\((CH_3)_2NH_2^+\)). La constante de ionización de la base \(K_b\) de la dimetilamina (\((CH_3)_2NH\)) es \(5,4 \times 10^{-4}\) a 25°C.
Dado: \(pK_a\) y \(K_b\)
Se pide: \(K_b\) y \(pK_b\) correspondientes, \(K_a\) y \(pK_a\)
Estrategia:
Las constantes \(K_a) y \(K_b\) están relacionadas como se muestra en la ecuación \(\ref{16.5.10}\). Las constantes \(pK_a\) y \(pK_b\) para un ácido y su base conjugada están relacionadas como se muestra en las ecuaciones \(\ref{16.5.15}\) y \(\ref{16.5.16}\). Utilice las relaciones pK = -log K y K = 10-pK (Ecuaciones \(\ref{16.5.11}\) y \(\ref{16.5.13}\)) para convertir entre \(K_a) y \(pK_a) o \(K_b\) y \(pK_b\).
Solución:
Se nos da el \(pK_a\) para el ácido butírico y se nos pide que calculemos el \(K_b\) y el \(pK_b\) para su base conjugada, el ion butirato. Como el valor de \(pK_a\) citado es para una temperatura de 25°C, podemos utilizar la ecuación \(pK_a\) + \(pK_b\) = pKw = 14,00. Sustituyendo el \(pK_a) y resolviendo para el \(pK_b\),
\
Debido a que \(pK_b = -\log K_b\), \(K_b\) es \(10^{-9,17} = 6,8 \times 10^{-10}\).
En este caso, se nos da \(K_b\) para una base (dimetilamina) y se nos pide que calculemos \(K_a\) y \(pK_a\) para su ácido conjugado, el ion dimetilamonio. Dado que la cantidad inicial dada es \(K_b\) en lugar de \(pK_b\), podemos utilizar la ecuación \(\ref{16.5.10}\N:) \(K_aK_b = K_w\). Sustituyendo los valores de \(K_b\) y \(K_w\) a 25°C y resolviendo para \(K_a\),
\Nsólo para el K_a\Nque es el valor de la ecuación, tenemos \(pK_a = -log \\Nde K_a), \Nlog(1,9 \Nveces 10^{-11}) = 10,72\N). También podríamos haber convertido \(K_b\) a \(pK_b\) para obtener la misma respuesta:
\
\
\
\
Si nos dan cualquiera de estas cuatro cantidades para un ácido o una base (\(K_a\), \(pK_a\), \(K_b\), o \(pK_b\)), podemos calcular las otras tres.
Ejercicio \(\PageIndex{1}}): Ácido láctico
El ácido láctico (\(CH_3CH(OH)CO_2H\)) es el responsable del sabor y el olor acre de la leche agria; también se cree que produce dolor en los músculos fatigados. Su \(pK_a\) es de 3,86 a 25°C. Calcule \(K_a\) para el ácido láctico y \(pK_b\) y \(K_b\) para el ión lactato.
Respuesta
- (K_a = 1,4 \\\Nveces 10^{-4}) para el ácido láctico;
- (pK_b\) = 1014 y
- (K_b = 7,2 \times 10^{-11}\) para el ion lactato
Soluciones de ácidos y bases fuertes: El efecto de nivelación
Notarás en la tabla \(\PageIndex{1}\) que ácidos como \(H_2SO_4\) y \(HNO_3\) se sitúan por encima del ion hidronio, lo que significa que tienen valores \(pK_a\) menores que cero y son ácidos más fuertes que el ion \(H_3O^+\). Recordemos del capítulo 4 que el protón ácido de prácticamente todos los oxoácidos está unido a uno de los átomos de oxígeno del oxoanión. Así, el ácido nítrico debería escribirse correctamente como \ (HONO_2\). Sin embargo, por desgracia, las fórmulas de los oxoácidos se escriben casi siempre con el hidrógeno a la izquierda y el oxígeno a la derecha, lo que da como resultado \(HNO_3\). De hecho, los seis ácidos fuertes comunes que encontramos por primera vez en el capítulo 4 tienen valores de \(pK_a) menores que cero, lo que significa que tienen una mayor tendencia a perder un protón que el ion \(H_3O^+\). Por el contrario, las bases conjugadas de estos ácidos fuertes son bases más débiles que el agua. En consecuencia, los equilibrios de transferencia de protones para estos ácidos fuertes se encuentran muy a la derecha, y la adición de cualquiera de los ácidos fuertes comunes al agua resulta en una reacción esencialmente estequiométrica del ácido con el agua para formar una solución del ion \(H_3O^+\) y la base conjugada del ácido.
Aunque el \(K_a\) para el \(HI\) es aproximadamente 108 mayor que el \(K_a\) para el \(HNO_3\), la reacción del \(HI\) o del \(HNO_3\) con el agua da una solución esencialmente estequiométrica de \(H_3O^+\) y I- o \(NO_3^-\). De hecho, una solución acuosa de 0,1 M de cualquier ácido fuerte contiene en realidad 0,1 M de \N(H_3O^+\), independientemente de la identidad del ácido fuerte. Este fenómeno se denomina efecto de nivelación: cualquier especie que sea un ácido más fuerte que el ácido conjugado del agua (\(H_3O^+\)) se nivela a la fuerza de \(H_3O^+\) en solución acuosa porque \(H_3O^+\) es el ácido más fuerte que puede existir en equilibrio con el agua. En consecuencia, es imposible distinguir entre las fuerzas de ácidos como el HI y el HNO3 en solución acuosa, y debe utilizarse un enfoque alternativo para determinar sus fuerzas ácidas relativas.
Un método es utilizar un disolvente como el ácido acético anhidro. Dado que el ácido acético es un ácido más fuerte que el agua, también debe ser una base más débil, con una menor tendencia a aceptar un protón que \(H_2O\). Las mediciones de la conductividad de soluciones 0,1 M tanto de HI como de \(HNO_3\) en ácido acético muestran que HI se disocia completamente, pero \(HNO_3\) sólo se disocia parcialmente y se comporta como un ácido débil en este disolvente. Este resultado nos dice claramente que el HI es un ácido más fuerte que el \(HNO_3\). El orden relativo de las fuerzas de los ácidos y los valores aproximados de \(K_a) y \(pK_a) para los ácidos fuertes en la parte superior de la tabla \(\PageIndex{1}) se determinaron utilizando mediciones como esta y diferentes disolventes no acuosos.
En soluciones acuosas, \(H_3O^+\) es el ácido más fuerte y \(OH^-\) es la base más fuerte que puede existir en equilibrio con \(H_2O\).
El efecto de nivelación se aplica también a las soluciones de bases fuertes: En una solución acuosa, cualquier base más fuerte que el OH- se nivela a la fuerza del OH- porque el OH- es la base más fuerte que puede existir en equilibrio con el agua. Sales como \(K_2O\), \(NaOCH_3\) (metóxido de sodio), y \(NaNH_2\) (sodamida, o amida de sodio), cuyos aniones son las bases conjugadas de las especies que estarían por debajo del agua en la Tabla \(\PageIndex{2}), son todas las bases fuertes que reaccionan esencialmente por completo (y a menudo violentamente) con el agua, aceptando un protón para dar una solución de \(OH^-\) y el catión correspondiente:
\
\
\
Otros ejemplos que puede encontrar son el hidruro de potasio (\(KH\)) y los compuestos organometálicos como el metil-litio (\(CH_3Li\)).
Ácidos y bases polipróticos
Como has aprendido, los ácidos polipróticos como \(H_2SO_4\), \(H_3PO_4\), y \(H_2CO_3\) contienen más de un protón ionizable, y los protones se pierden de forma escalonada. La especie totalmente protonada es siempre el ácido más fuerte porque es más fácil eliminar un protón de una molécula neutra que de un ion cargado negativamente. Por lo tanto, la fuerza del ácido disminuye con la pérdida de los protones subsiguientes y, en consecuencia, el \ (pK_a) aumenta. Considere \(H_2SO_4\), por ejemplo:
\
El equilibrio en la primera reacción se encuentra muy a la derecha, consistente con \(H_2SO_4\) siendo un ácido fuerte. En cambio, en la segunda reacción, cantidades apreciables tanto de \(HSO_4^-\) como de \(SO_4^{2-}\) están presentes en el equilibrio.
Para un ácido poliprótico, la fuerza del ácido disminuye y el \(pK_a\) aumenta con la pérdida secuencial de cada protón.
El ion sulfato de hidrógeno (\(HSO_4^-\)) es tanto la base conjugada de \(H_2SO_4\) como el ácido conjugado de \(SO_4^{2-}\). Por tanto, al igual que el agua, el HSO4- puede actuar como ácido o como base, dependiendo de si el otro reactivo es un ácido más fuerte o una base más fuerte. Por el contrario, el ion sulfato (\(SO_4^{2-}\)) es una base poliprótica que es capaz de aceptar dos protones de forma escalonada:
\
\
Como cualquier otro par ácido-base conjugado, las fuerzas de los ácidos y las bases conjugadas están relacionadas por \(pK_\) + \(pK_b\) = pKw. Consideremos, por ejemplo, el par ácido-base conjugado \(HSO_4^-/ SO_4^{2-}). A partir de la Tabla \(\PageIndex{1}), vemos que el \(pK_a\) de \(HSO_4^-\) es 1,99. Por lo tanto, el \ (pK_b\) de \ (SO_4^{2-}\) es 14,00 – 1,99 = 12,01. Por lo tanto, el sulfato es una base bastante débil, mientras que \(OH^-\) es una base fuerte, por lo que el equilibrio mostrado en la ecuación \(\ref{16,6}\) se encuentra a la izquierda. El ion \(HSO_4^-\) es también una base muy débil (\(pK_a) de \(H_2SO_4\) = 2,0, \(pK_b\) de \(HSO_4^- = 14 – (-2,0) = 16\)), que es consistente con lo que esperamos para la base conjugada de un ácido fuerte.
Ejemplo \(\PageIndex{2})
Predice si el equilibrio para cada reacción se encuentra a la izquierda o a la derecha como está escrito.
- (NH^+_{4(aq)}+PO^{3-}_4(aq)} \rightleftharpoons NH_{3(aq)}+HPO^{2−}_{4(aq)}\)
- \(CH_3CH_2CO_2H_{(aq)}+CN^−_{(aq)} \rightleftharpoons CH_3CH_2CO^-_{2(aq)}+HCN_{(aq)})
Dado: ecuación química equilibrada
Se pide: posición de equilibrio
Estrategia:
Identificar los pares ácido-base conjugados en cada reacción. A continuación, consulte las tablas \(\PageIndex{1})y{\}(\PageIndex{2})y la figura \(\PageIndex{2})para determinar cuál es el ácido y la base más fuerte. El equilibrio siempre favorece la formación del par ácido-base más débil.
Solución:
Los pares ácido-base conjugados son \(NH_4^+/NH_3\) y \(HPO_4^{2-}/PO_4^{3-}). Según las tablas \(\PageIndex{1}) y \(\PageIndex{2}), \(NH_4^+) es un ácido más fuerte (\(pK_a = 9.25\)) que \(HPO_4^{2-}\) (pKa = 12,32), y \(PO_4^{3-}\) es una base más fuerte (\(pK_b = 1,68\)) que \(NH_3) (\(pK_b = 4,75\)). Por lo tanto, el equilibrio se situará a la derecha, favoreciendo la formación del par ácido-base más débil:
\
Los pares ácido-base conjugados son \(CH_3CH_2CO_2H/CH_3CH_2CO_2^-\) y \(HCN/CN^-\). Según la tabla \(\PageIndex{1}), el HCN es un ácido débil (pKa = 9,21) y el \(CN^-\) es una base moderadamente débil (pKb = 4,79). Sin embargo, el ácido propiónico (\(CH_3CH_2CO_2H\)) no aparece en la tabla \(\PageIndex{1}). En una situación como ésta, lo mejor es buscar un compuesto similar cuyas propiedades ácido-base estén listadas. Por ejemplo, el ácido propiónico y el ácido acético son idénticos excepto por los grupos unidos al átomo de carbono del ácido carboxílico (\(\ce{-CH_2CH_3}\) frente a \(\ce{-CH_3}\)), por lo que podríamos esperar que los dos compuestos tengan propiedades ácido-base similares. En particular, esperaríamos que el \(pK_a\) del ácido propiónico fuera similar en magnitud al \(pK_a\) del ácido acético. (De hecho, el \(pK_a) del ácido propiónico es de 4,87, comparado con el 4,76 del ácido acético, lo que hace del ácido propiónico un ácido ligeramente más débil que el ácido acético). Por tanto, el ácido propiónico debería ser un ácido significativamente más fuerte que el \(HCN\). Como el ácido más fuerte forma la base conjugada más débil, predecimos que el cianuro será una base más fuerte que el propionato. Por lo tanto, el equilibrio se situará a la derecha, favoreciendo la formación del par ácido-base más débil:
\NDiscuta si el equilibrio para cada reacción se sitúa a la izquierda o a la derecha como está escrito.
- (H_2O_(l)}+HS^-_(aq)} \rightleftharpoons OH^−_{(aq)}+H_2S_{(aq)}\)
- \(HCO^−_{2(aq)}+HSO^−_{4(aq)} \rightleftharpoons HCO_2H_{(aq)}+SO^{2-}_{4(aq)})
Respuesta a
izquierda
Respuesta b
izquierda
Resumen
Las reacciones ácido-base siempre contienen dos pares ácido-base conjugados. Cada ácido y cada base tienen una constante de ionización asociada que corresponde a su fuerza ácida o básica. Dos especies que difieren sólo por un protón constituyen un par ácido-base conjugado. La magnitud de la constante de equilibrio para una reacción de ionización puede utilizarse para determinar las fuerzas relativas de los ácidos y las bases. Para una solución acuosa de un ácido débil, la constante de disociación se llama constante de ionización del ácido (\(K_a\)). Del mismo modo, la constante de equilibrio para la reacción de una base débil con el agua es la constante de ionización de la base (\(K_b\)). Para cualquier par ácido-base conjugado, \(K_aK_b = K_w\). Los valores más pequeños de \(pK_a\) corresponden a constantes de ionización de ácidos más grandes y, por tanto, a ácidos más fuertes. A la inversa, los valores más pequeños de \(pK_b\) corresponden a constantes de ionización de bases más grandes y, por tanto, a bases más fuertes. A 25°C, \(pK_a + pK_b = 14,00\). Las reacciones ácido-base proceden siempre en la dirección que produce el par ácido-base más débil. No puede existir ningún ácido más fuerte que \(H_3O^+\) ni ninguna base más fuerte que \(OH^-\) en solución acuosa, lo que da lugar al fenómeno conocido como efecto de nivelación. Los ácidos (y las bases) polipróticos pierden (y ganan) protones de forma escalonada, siendo la especie totalmente protonada el ácido más fuerte y la especie totalmente desprotonada la base más fuerte.
Ecuaciones clave
- Constante de ionización del ácido: \=\dfrac{}{} \}]
- Constante de ionización de la base: \= \dfrac{}{} \}
- Relación entre \(K_a\) y \(K_b\) de un par ácido-base conjugado: \
- Definición de \(pK_a\): \
- Definición de \(pK_b\): \
- Relación entre \(pK_a\) y \(pK_b\) de un par ácido-base conjugado: \ \
Contribuidores y Atribuciones
-
Stephen Lower, Profesor Emérito (Simon Fraser U.) Chem1 Virtual Textbook