Entropía
En la naturaleza hay una tendencia a que los sistemas avancen hacia un estado de mayor desorden o aleatoriedad. La entropía es una medida del grado de aleatoriedad o desorden de un sistema. La entropía es un concepto fácil de entender cuando se piensa en situaciones cotidianas. La entropía de una habitación que se ha limpiado y organizado recientemente es baja. Con el paso del tiempo, es probable que se desordene más y, por tanto, su entropía aumente (véase la figura siguiente). La tendencia natural de un sistema es que su entropía aumente.
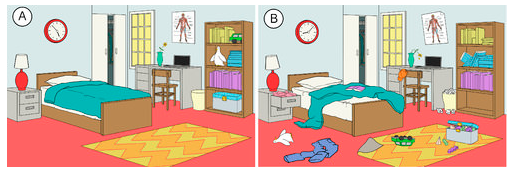
Las reacciones químicas también tienden a proceder de tal manera que aumentan la entropía total del sistema. ¿Cómo se puede saber si una determinada reacción muestra un aumento o una disminución de la entropía? El estado molecular de los reactivos y los productos proporciona ciertas pistas. Los casos generales que se presentan a continuación ilustran la entropía a nivel molecular.
- Para una determinada sustancia, la entropía del estado líquido es mayor que la entropía del estado sólido. Asimismo, la entropía del gas es mayor que la entropía del líquido. Por tanto, la entropía aumenta en los procesos en los que los reactantes sólidos o líquidos forman productos gaseosos. La entropía también aumenta cuando los reactantes sólidos forman productos líquidos.
- La entropía aumenta cuando una sustancia se descompone en múltiples partes. El proceso de disolución aumenta la entropía porque las partículas del soluto se separan unas de otras cuando se forma una solución.
- La entropía aumenta al aumentar la temperatura. Un aumento de la temperatura significa que las partículas de la sustancia tienen mayor energía cinética. Las partículas que se mueven más rápido tienen más desorden que las partículas que se mueven más lentamente a una temperatura más baja.
- La entropía generalmente aumenta en las reacciones en las que el número total de moléculas del producto es mayor que el número total de moléculas del reactante. Una excepción a esta regla es cuando se produce un gas a partir de reactantes no gaseosos.
Los ejemplos siguientes servirán para ilustrar cómo se puede predecir el cambio de entropía en una reacción.
(\ce{Cl_2} \izquierda( g \ ~ derecha) \ ~ flecha derecha \ce{Cl_2} \izquierda ( l derecha)))
La entropía está disminuyendo porque un gas se está convirtiendo en un líquido.
(KaCO_3) \a la izquierda( s \a la derecha) \a la flecha \a la izquierda( s \a la derecha) \a la flecha \a la izquierda( s \a la derecha) \izquierda( s \ derecha) + \ce{CO_2} \left( g \right)\\N-)
La entropía está aumentando porque se está produciendo un gas y el número de moléculas está aumentando.
\N-(\ce{N_2} izquierda( g \\ derecha) + 3 \ce{H_2} \izquierda (g) derecha) flecha 2 \left( g \right)\\N-)
La entropía está disminuyendo porque cuatro moléculas totales de reactivo están formando dos moléculas totales de producto. Todas son gases.
(\ce{AgNO_3} \izquierda( aq \a la derecha) + \ce{NaCl} \izquierda (aq) derecha) flecha derecha. \izquierda (aq. derecha) + azufre (AgCl) \left( s \right)\\N-)
La entropía disminuye porque se forma un sólido a partir de los reactivos acuosos.
(\ce{H_2} \izquierda ( g \ ~ derecha) + \ce{Cl_2} \izquierda (g) derecha) flecha 2 HCl \left( g \right)\\N-)
El cambio de entropía es desconocido (pero probablemente no sea cero), porque hay igual número de moléculas en ambos lados de la ecuación y todas son gases.