El Modelo Atómico
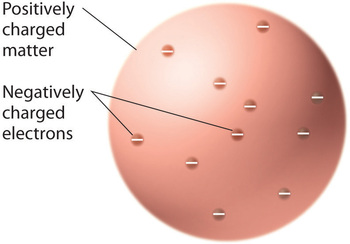
Una vez que los científicos llegaron a la conclusión de que toda la materia contiene electrones con carga negativa, quedó claro que los átomos, que son eléctricamente neutros, también deben contener cargas positivas para equilibrar las negativas. Thomson propuso que los electrones estaban incrustados en una esfera uniforme que contenía tanto la carga positiva como la mayor parte de la masa del átomo, de forma parecida a las pasas en el pudín de ciruela o a las pepitas de chocolate en una galleta (Figura \(\PageIndex{9}\))
2.4.6
Figura \(\PageIndex{9}\): El modelo del átomo de Thomson, el «Plum Pudding» o «Chocolate Chip Cookie». En este modelo, los electrones están incrustados en una esfera uniforme de carga positiva. Imagen utilizada con permiso (CC BY-SA-NC).
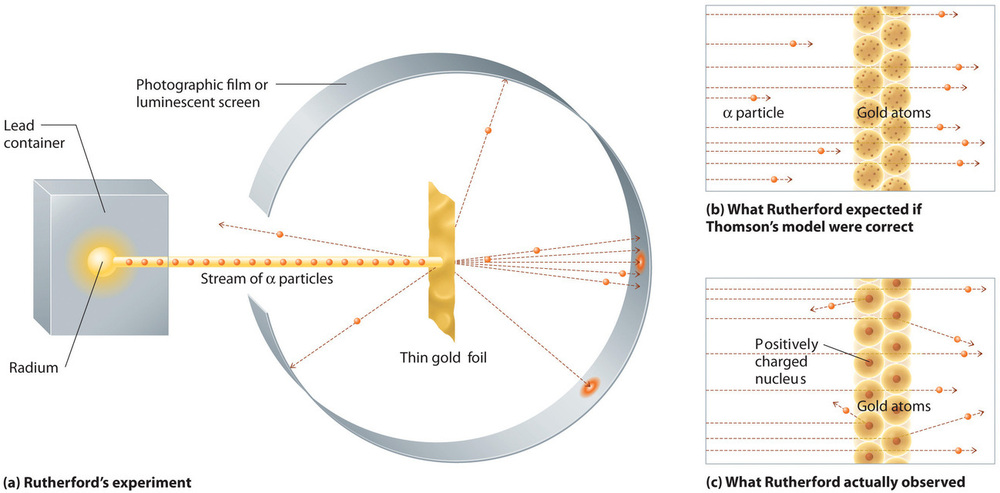
Sin embargo, en un único y famoso experimento, Rutherford demostró inequívocamente que el modelo del átomo de Thomson era incorrecto. Rutherford apuntó una corriente de partículas α a un objetivo de lámina de oro muy delgada (Figura \PageIndex{10a}\)) y examinó cómo las partículas α eran dispersadas por la lámina. Se eligió el oro porque podía martillearse fácilmente en láminas extremadamente finas, minimizando el número de átomos en el blanco. Si el modelo del átomo de Thomson fuera correcto, las partículas α cargadas positivamente deberían estrellarse a través de la masa uniformemente distribuida del blanco de oro como balas de cañón a través del lado de una casa de madera. Para el asombro de Rutherford, una pequeña fracción de las partículas α se desviaba en grandes ángulos, y algunas se reflejaban directamente en la fuente (Figura \PageIndex{10b}\). Según Rutherford, «era casi tan increíble como si dispararas un proyectil de 15 pulgadas a un trozo de papel de seda y éste volviera y te golpeara»
2.4.7
Figura \(\PageIndex{10}\): Un resumen de los experimentos de Rutherford. (a) Representación del aparato que utilizó Rutherford para detectar las desviaciones de una corriente de partículas α dirigidas a un blanco de lámina de oro delgada. Las partículas fueron producidas por una muestra de radio. (b) Si el modelo del átomo de Thomson fuera correcto, las partículas α deberían haber atravesado directamente la lámina de oro. (c) Sin embargo, un pequeño número de partículas α fueron desviadas en varias direcciones, incluso de vuelta a la fuente. Esto sólo podría ser cierto si la carga positiva fuera mucho más masiva que la partícula α. Sugirió que la masa del átomo de oro se concentra en una región muy pequeña del espacio, a la que llamó núcleo. Imagen utilizada con permiso (CC BY-SA-NC).
Los resultados de Rutherford no eran consistentes con un modelo en el que la masa y la carga positiva se distribuyen uniformemente por el volumen de un átomo. Por el contrario, sugerían fuertemente que tanto la masa como la carga positiva se concentraban en una pequeña fracción del volumen de un átomo, que Rutherford llamaba el núcleo. Tenía sentido que una pequeña fracción de las partículas α colisionara con los densos núcleos cargados positivamente, bien de refilón, dando lugar a grandes desviaciones, o bien casi de frente, haciendo que se reflejaran directamente en la fuente.
Aunque Rutherford no pudo explicar por qué las repulsiones entre las cargas positivas de los núcleos que contenían más de una carga positiva no hacían que el núcleo se desintegrara, razonó que las repulsiones entre los electrones cargados negativamente harían que los electrones se distribuyeran uniformemente por todo el volumen del átomo.Hoy se sabe que las fuerzas nucleares fuertes, que son mucho más fuertes que las interacciones electrostáticas, mantienen unidos a los protones y a los neutrones en el núcleo. Por este y otros conocimientos, Rutherford recibió el Premio Nobel de Química en 1908. Desgraciadamente, Rutherford habría preferido recibir el Premio Nobel de Física porque consideraba que la física era superior a la química. En su opinión, «toda la ciencia es o bien física o bien coleccionismo de sellos».
 2.4.8
2.4.8
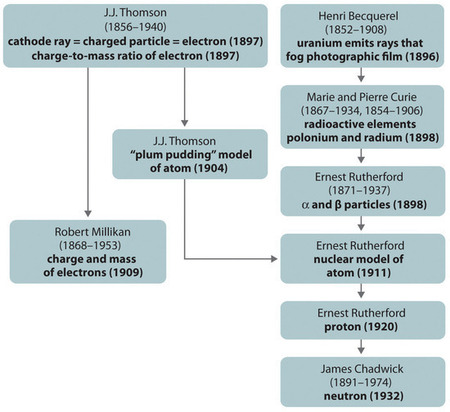
Figura \N(\N- PageIndex{11}\N-): Resumen del desarrollo histórico de los modelos de los componentes y la estructura del átomo. Las fechas entre paréntesis son los años en los que se realizaron los experimentos clave. Imagen utilizada con permiso (CC BY-SA-NC).
El desarrollo histórico de los diferentes modelos de la estructura del átomo se resume en (Figura \(\PageIndex{11}\)) Rutherford estableció que el núcleo del átomo de hidrógeno era una partícula con carga positiva, para la que acuñó el nombre de protón en 1920. También sugirió que los núcleos de los elementos distintos del hidrógeno debían contener partículas eléctricamente neutras con aproximadamente la misma masa que el protón. Sin embargo, el neutrón no se descubrió hasta 1932, cuando James Chadwick (1891-1974, alumno de Rutherford; Premio Nobel de Física, 1935) lo descubrió. Como resultado del trabajo de Rutherford, quedó claro que una partícula α contiene dos protones y neutrones, y es, por tanto, el núcleo de un átomo de helio.
2.4.9
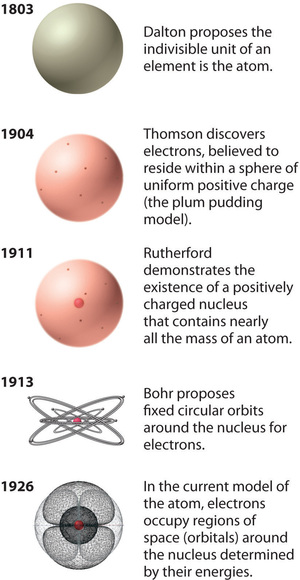
Figura \N(\PageIndex{12}\N): La evolución de la teoría atómica, ilustrada por los modelos del átomo de oxígeno. El modelo de Bohr y el modelo actual se describen en el capítulo 6, «La estructura de los átomos». Imagen utilizada con permiso (CC BY-SA-NC).
El modelo del átomo de Rutherford es esencialmente el mismo que el modelo moderno, salvo que ahora se sabe que los electrones no están distribuidos uniformemente por el volumen del átomo. En cambio, se distribuyen de acuerdo con un conjunto de principios descritos por la Mecánica Cuántica. La figura \ (\PageIndex{12}\) muestra cómo ha evolucionado el modelo del átomo a lo largo del tiempo, desde la unidad indivisible de Dalton hasta la visión moderna que se enseña hoy en día.