Objetivos de aprendizaje
- Entender la representación 3D de los orbitales electrónicos
Un orbital es el refinamiento mecánico cuántico del orbital de Bohr. En contraste con su concepto de una simple órbita circula(r\) con un radio fijo, los orbitales son regiones del espacio derivadas matemáticamente con diferentes probabilidades de contener un electrón.
Una forma de representar las distribuciones de probabilidad de los electrones se ilustró anteriormente fo(r\) el orbital 1s del hidrógeno. Dado que Ψ2 da la probabilidad de encontrar un electrón en un determinado volumen de espacio (como un picómetro cúbico), un gráfico de Ψ2 frente a la distancia al núcleo (r) es un gráfico de la densidad de probabilidad. El orbital 1s es esféricamente simétrico, por lo que la probabilidad de encontrar un electrón 1s en un punto determinado depende sólo de su distancia al núcleo. La densidad de probabilidad es mayor en \(\(r\) = 0\) (en el núcleo) y disminuye constantemente al aumentar la distancia. En valores muy grandes de r, la densidad de probabilidad del electrón es muy pequeña, pero no nula.
En cambio, podemos calcular la probabilidad radial (la probabilidad de encontrar un electrón 1s a una distancia \(r\) del núcleo) sumando las probabilidades de que un electrón esté en todos los puntos de una serie de x envolturas esféricas de radio r1, r2, r3,…, rx – 1, rx. En efecto, estamos dividiendo el átomo en cáscaras concéntricas muy finas, como las capas de una cebolla (Figura \(\PageIndex{1a})), y calculando la probabilidad de encontrar un electrón en cada cáscara esférica. Recordemos que la densidad de probabilidad de los electrones es mayor en \(r\) = 0 (Figura \(\PageIndex{1}\)), por lo que la densidad de puntos es mayor fo(r\) las cáscaras esféricas más pequeñas en la parte (a) en la Figura \(\PageIndex{1}\). Por el contrario, el área de la superficie de cada cáscara esférica es igual a \(4πr^2\), que aumenta muy rápidamente con el aumento de \(r\) (Figura \(\PageIndex{1c}\)). Debido a que la superficie de las cáscaras esféricas aumenta más rápidamente con el aumento de \(r\) que la densidad de probabilidad de los electrones disminuye, la parcela de la probabilidad radial tiene un máximo en un particula\(r\) distancia (Figura \(\PageIndex{1d}\). Lo más importante es que cuando \(r\) es muy pequeño, la superficie de una cáscara esférica es tan pequeña que la probabilidad total de encontrar un electrón cerca del núcleo es muy baja; en el núcleo, la probabilidad del electrón se desvanece (Figura \(\PageIndex{1d})).

En el átomo de hidrógeno, el pico en el gráfico de probabilidad radial se produce en \(r\) = 0,529 Å (52,9 pm), que es exactamente el radio calculado por Boh\(r\) para la órbita n = 1. Así, el radio más probable obtenido a partir de la mecánica cuántica es idéntico al radio calculado por la mecánica clásica. Sin embargo, en el modelo de Bohr se suponía que el electrón estaba a esta distancia el 100% del tiempo, mientras que en el modelo de Schrödinge\(r\) sólo está a esta distancia una parte del tiempo. La diferencia entre los dos modelos es atribuible al comportamiento ondulatorio del electrón y al principio de incertidumbre de Heisenberg.
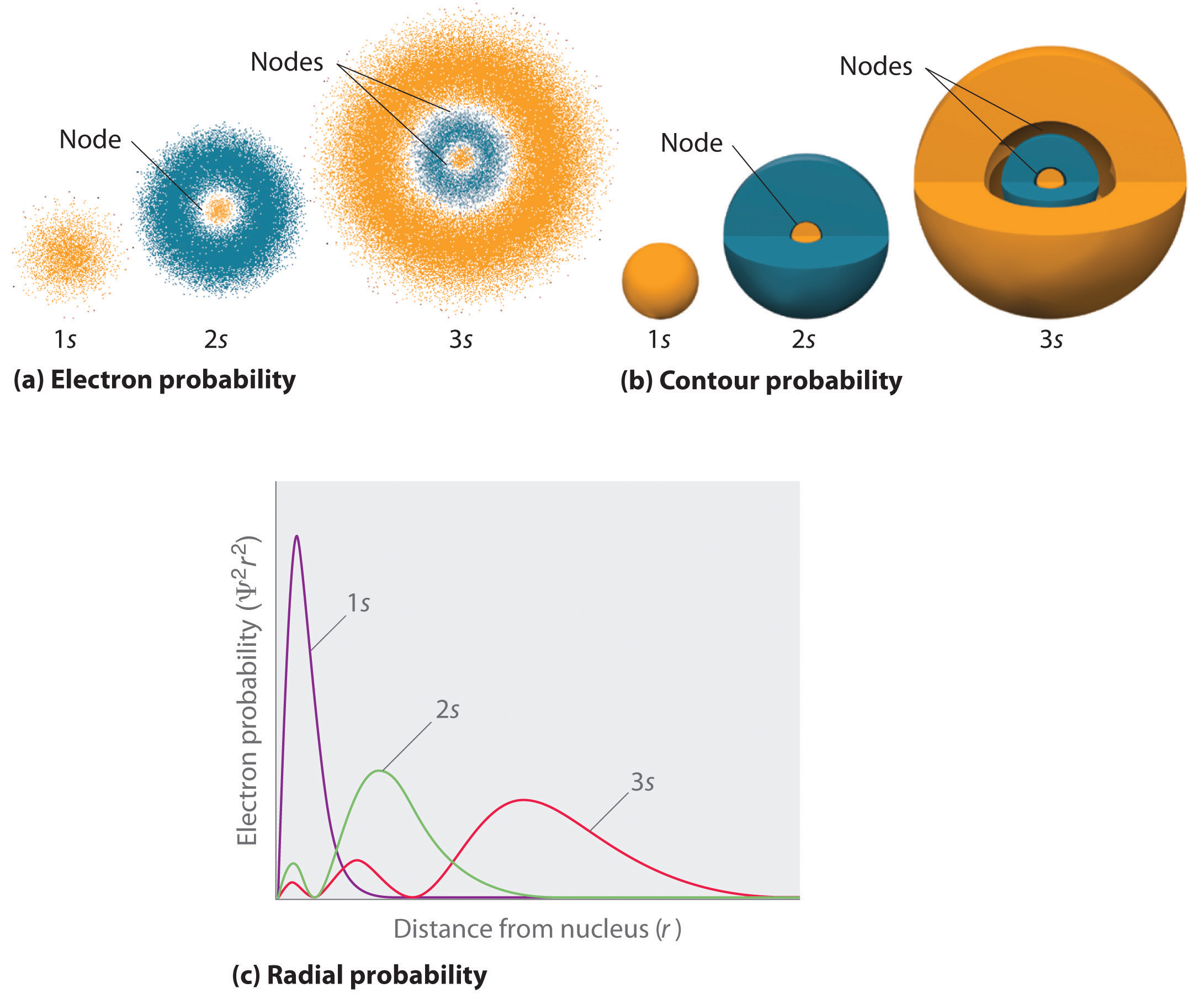
La figura (\PageIndex{2}) compara las densidades de probabilidad del electrón para los orbitales 1s, 2s y 3s del hidrógeno. Nótese que los tres son esféricamente simétricos. Para los orbitales 2s y 3s, sin embargo (y para todos los demás orbitales s también), la densidad de probabilidad de los electrones no cae suavemente con el aumento de \N(r\). En su lugar, se observa una serie de mínimos y máximos en los gráficos de probabilidad radial (Figura \(\PageIndex{2c}\)). Los mínimos corresponden a nodos esféricos (regiones de probabilidad electrónica nula), que se alternan con regiones esféricas de probabilidad electrónica no nula. La existencia de estos nodos es una consecuencia de los cambios de fase de onda en la función de onda Ψ.
Orbitales s (l=0)
Tres cosas suceden a los orbitales s a medida que n aumenta (Figura \(\PageIndex{2}\)):
- Se hacen más grandes, extendiéndose más lejos del núcleo.
- Contienen más nodos. Esto es similar a una onda estacionaria que tiene regiones de amplitud significativa separadas por nodos, puntos con amplitud cero.
- En un átomo dado, los orbitales s también se vuelven más altos en energía a medida que n aumenta debido a la mayor distancia del núcleo.
Los orbitales se dibujan generalmente como superficies tridimensionales que encierran el 90% de la densidad de electrones, como se mostró para los orbitales 1s, 2s y 3s del hidrógeno en la parte (b) de la figura. Aunque estos dibujos muestran los tamaños relativos de los orbitales, normalmente no muestran los nodos esféricos en los orbitales 2s y 3s porque los nodos esféricos se encuentran dentro de la superficie del 90%. Afortunadamente, las posiciones de los nodos esféricos no son importantes para el enlace químico.
Orbitales p (l=1)
Sólo los orbitales s son esféricamente simétricos. A medida que aumenta el valor de l, se incrementa el número de orbitales en un determinado subesqueleto, y las formas de los orbitales se vuelven más complejas. Como el subesqueleto 2p tiene l = 1, con tres valores de ml (-1, 0, y +1), hay tres orbitales 2p.
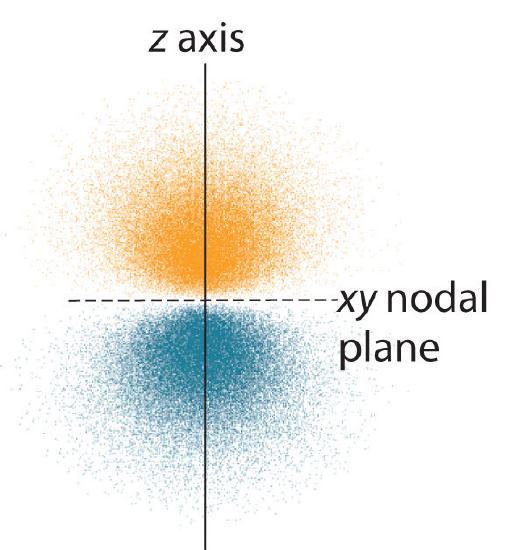
En la Figura \(\PageIndex{3}\Nse muestra la distribución de probabilidad de los electrones para uno de los orbitales 2p del hidrógeno. Debido a que este orbital tiene dos lóbulos de densidad de electrones dispuestos a lo largo del eje z, con una densidad de electrones de cero en el plano xy (es decir, el plano xy es un plano nodal), es un orbital \(2p_z\). Como se muestra en la Figura \(\PageIndex{4}\), el other\(r\) dos orbitales 2p tienen formas idénticas, pero se encuentran a lo largo del eje x (\(2p_x\)) y el eje y (\(2p_y\)), respectivamente. Nótese que cada orbital p tiene un solo plano nodal. En cada caso, la fase de la función de onda fo\(r\) de cada uno de los orbitales 2p es positiva fo\(r\) el lóbulo que apunta a lo largo del eje positivo y negativa fo\(r\) el lóbulo que apunta a lo largo del eje negativo. Es importante destacar que estos signos corresponden a la fase de la onda que describe el movimiento de los electrones, no a las cargas positivas o\(r\) negativas.
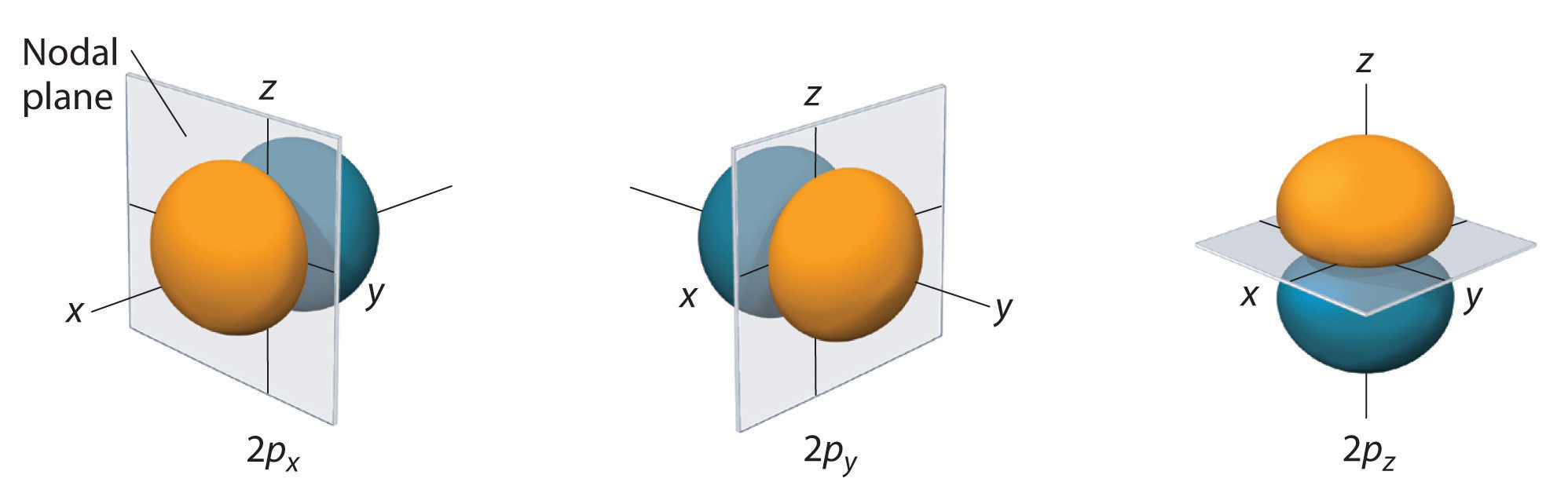
Las superficies mostradas encierran el 90% de la probabilidad total de los electrones fo\(r\) los orbitales 2px, 2py, y 2pz. Cada orbital está orientado a lo largo del eje indicado por el subíndice y un plano nodal que es perpendicular(r\) a ese eje biseca cada orbital 2p. La fase de la función de onda es positiva (naranja) en la región del espacio donde x, y, o\(r\) z es positiva y negativa (azul) donde x, y, o\(r\) z es negativa. Al igual que con los orbitales s, el tamaño y la complejidad de los orbitales p fo(r\) de cualquier átomo aumentan a medida que aumenta el número cuántico principalbe(r\) n. Las formas de las superficies de probabilidad del 90% de los orbitales p de 3p, 4p y de mayor energía son, sin embargo, esencialmente las mismas que las mostradas en la Figura \(\PageIndex{4}\).
Orbitales d (l=2)
Las subcáscaras con l = 2 tienen cinco orbitales d; la primera cáscara principal en tener una subcáscara d corresponde a n = 3. Los cinco orbitales d tienen valores ml de -2, -1, 0, +1 y +2.
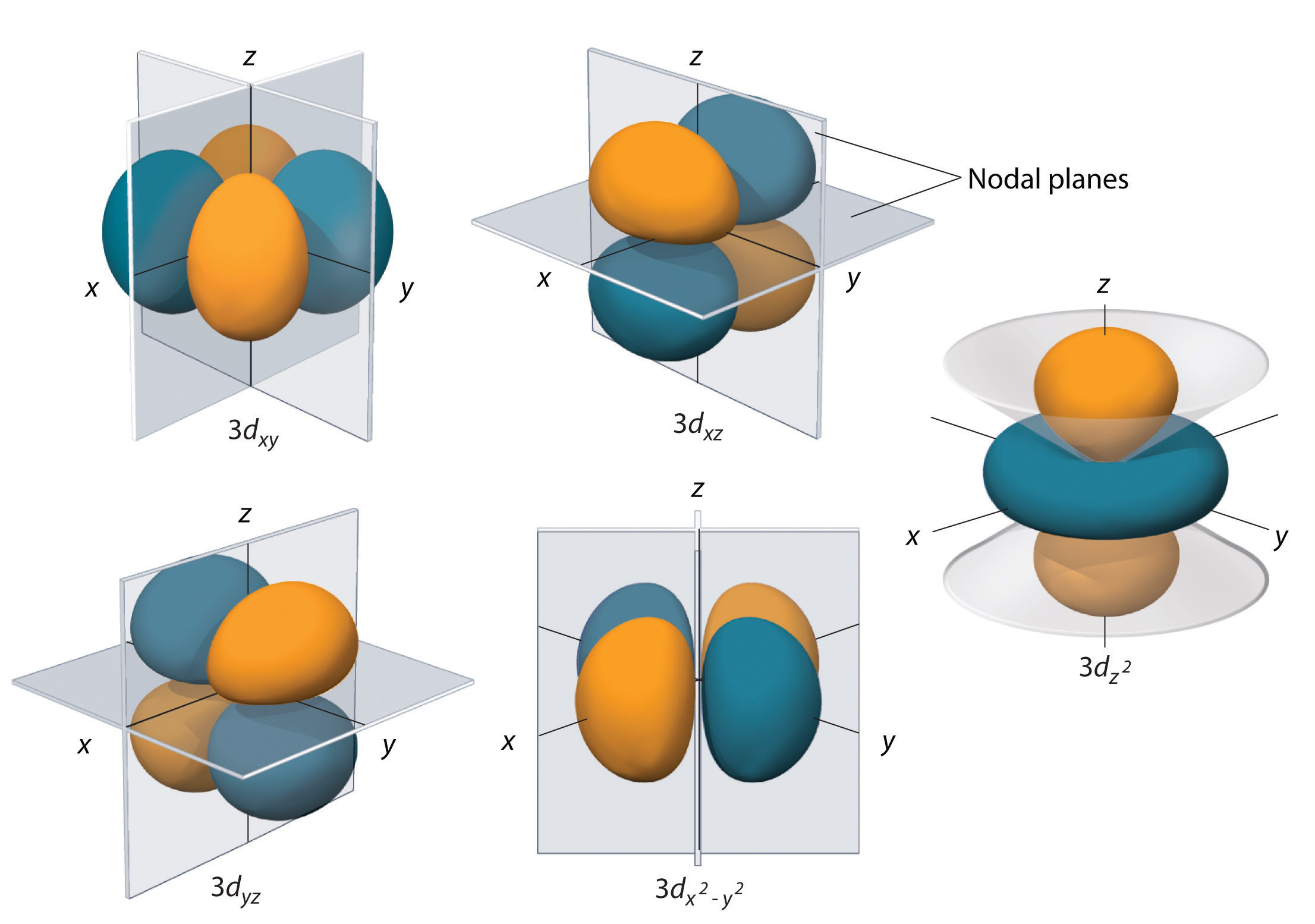
Los orbitales 3d del hidrógeno, mostrados en la figura \(\PageIndex{5}\), tienen formas más complejas que los orbitales 2p. Los cinco orbitales 3d contienen dos superficies nodales, en comparación con una fo(r\) cada orbital p y cero fo(r\) cada orbital s. En tres de los orbitales d, los lóbulos de la densidad de electrones están orientados entre los planos x e y, x y z, e y z; estos orbitales se denominan orbitales \(3d_{xy}\), \)3d_{xz}\), y \(3d_{yz}\), respectivamente. Un cuarto orbital d tiene lóbulos a lo largo de los ejes x e y; este es el orbital \(3d_{x^2-y^2}). El quinto orbital 3d, llamado orbital \(3d_{z^2}), tiene una forma única: parece un orbital \(2p_z\) combinado con un donut adicional de probabilidad de electrones situado en el plano xy. A pesar de su peculiar forma, el orbital \(3d_{z^2}) es matemáticamente equivalente al otro\(r\) fou(r\) y tiene la misma energía. A diferencia de los orbitales p, la fase de la función de onda de los orbitales d es la misma para los pares de lóbulos opuestos. Como se muestra en la Figura \(\PageIndex{5}\), la fase de la función de onda es positiva fo\(r\) los dos lóbulos del orbital \(dz^2\) que se encuentran a lo largo del eje z, mientras que la fase de la función de onda es negativa fo\(r\) la rosquilla de la densidad de electrones en el plano xy. Al igual que los orbitales s y p, a medida que aumenta n, aumenta el tamaño de los orbitales d, pero las formas generales siguen siendo simila(r\) a las representadas en la figura \(\PageIndex{5}).
Orbitales f (l=3)
Las cáscaras principales con n = 4 pueden tener subcáscaras con l = 3 y valores ml de -3, -2, -1, 0, +1, +2 y +3. Estas subcáscaras constan de siete orbitales f. Cada orbital f tiene tres superficies nodales, por lo que las formas i\(r\) son complejas. Debido a que los orbitales f no son particularmente importantes para los propósitos de ou(r\), no los discutimos más, y los orbitales con valores altos de l no se discuten en absoluto.
Energías orbitales
Aunque hemos discutido las formas de los orbitales, hemos dicho poco sobre las energías comparativas de ou(r\). Comenzamos nuestra discusión de las energías orbitales considerando átomos o iones con un solo electrón (como el H o He+).
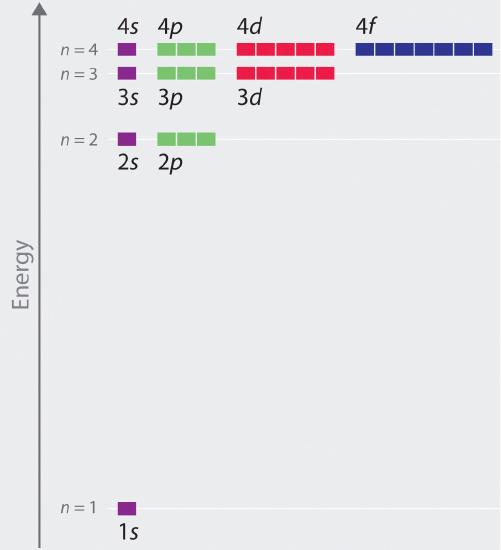
Las energías relativas de los orbitales atómicos con n ≤ 4 para un átomo de hidrógeno se representan en la figura; nótese que las energías orbitales dependen sólo del número cuántico principal n. En consecuencia, las energías de los orbitales 2s y 2p del hidrógeno son las mismas; las energías de los orbitales 3s, 3p y 3d son las mismas; y así sucesivamente. La mecánica cuántica predice que en el átomo de hidrógeno, todos los orbitales con el mismo valor de n (por ejemplo, los tres orbitales 2p) son degenerados, lo que significa que tienen la misma energía. Las energías orbitales obtenidas para el hidrógeno usando la mecánica cuántica son exactamente las mismas que las energías permitidas calculadas por Boh\(r\). Sin embargo, a diferencia del modelo de Bohr, que sólo permitía un orbital fo\(r\) cada nivel de energía, la mecánica cuántica predice que hay 4 orbitales con diferentes distribuciones de densidad de electrones en la capa principal n = 2 (un orbital 2s y tres 2p), 9 en la capa principal n = 3 y 16 en la capa principal n = 4.Los diferentes valores de l y ml de los orbitales individuales dentro de una determinada capa principal no son importantes para entender los espectros de emisión y absorción del átomo de hidrógeno en la mayoría de las condiciones, pero explican los desdoblamientos de las líneas principales que se observan cuando los átomos de hidrógeno se colocan en un campo magnético. La figura \(\PageIndex{6}} muestra que los niveles de energía se acercan(r\) y se acercan(r\) a medida que aumenta el valor de n, como se esperaba debido a la dependencia 1/n2 de las energías orbitales.
Las energías de los orbitales en cualquier especie con un solo electrón pueden calcularse mediante una variación mino(r\) de la ecuación de Bohr, que puede extenderse a otras especies de un solo electrón incorporando la carga \(Z\) del núcleo (el número de protones en el núcleo):
\NEn general, tanto la energía como el radio disminuyen a medida que aumenta la carga del núcleo(r\). Así, los orbitales más estables (los de menor energía) son los más cercanos al núcleo. Fo\(r\) ejemplo, en el estado básico del átomo de hidrógeno, el único electrón está en el orbital 1s, mientras que en el primer estado excitado, el átomo ha absorbido energía y el electrón ha sido promovido a uno de los orbitales n = 2. En los iones con un solo electrón, la energía de un orbital dado depende sólo de n, y todas las subcáscaras dentro de una cáscara principal, como los orbitales \(p_x\), \(p_y\) y \(p_z\), son degenerados.
Resumen
Los tipos de orbitales atómicos químicamente importantes corresponden a valores de \(\ell = 0\), \(1\), \(2\), y \(3\). Los orbitales con \(\ell = 0\) son orbitales s y son esféricamente simétricos, con la mayor probabilidad de encontrar el electrón en el núcleo. Todos los orbitales con valores de \(n > 1\) y \(ell = 0\) contienen uno o\(r\) más nodos. Los orbitales con \(\ell = 1\) son orbitales p y contienen un plano nodal que incluye el núcleo, dando lugar a una forma de campana. Los orbitales con \(\ell = 2\) son orbitales d y tienen formas más complejas con al menos dos superficies nodales. Los orbitales con \(\ell = 3\) son orbitales f, que son aún más complejos.
Debido a que su distancia media al núcleo determina la energía de un electrón, cada orbital atómico con un conjunto dado de números cuánticos tiene una energía particula(r\) asociada, la energía orbital.
\NEn los átomos o(r\) iones con un solo electrón, todos los orbitales con el mismo valor de \(n\) tienen la misma energía (son degenerados), y las energías de las capas principales aumentan suavemente a medida que aumenta \(n\). Un átomo o(r\) ión con el/los electrón/es en el/los orbital/es de menor energía se dice que está en su estado básico, mientras que un átomo o(r\) ión en el que uno o(r\) más electrones ocupan orbitales de mayor energía se dice que está en un estado excitado.
Contribuidores y atribuciones
-
Modificado por Joshua Halpern (Howard University)