El elemento químico helio está clasificado como un gas noble y un no metal. Fue descubierto en 1895 por William Ramsay.

Zona de datos
| Clasificación: | El helio es un gas noble y un no metal |
| Color: | incoloro |
| Peso atómico: | 4.00260 |
| Estado: | gas |
| Punto de fusión: | -272,2 oC, 0,95 K |
| Nota: A la presión atmosférica normal, el helio no se solidifica y por tanto no tiene punto de fusión. El punto de fusión citado anteriormente es bajo una presión de 25 atmósferas. | |
| Punto de ebullición: | -268,9 oC, 4.2 K |
| Electrones: | 2 |
| Protones: | 2 |
| Neutrones en el isótopo más abundante: | 2 |
| Configuración de electrones: | 2 |
| Configuración de electrones: | 1s2 |
| Densidad a 20oC: | 0.0001787 g/cm3 |
Mostrar más, incluyendo: Calores, Energías, Oxidación,
Reacciones, Compuestos, Radios, Conductividades
| Volumen atómico: | 27,2 cm3/mol |
| Estructura: | generalmente hexagonal de paquete cerrado |
| (v.alta presión necesaria para solidificar el helio) | |
| Capacidad calorífica específica | 5,193 J g-1 K-1 |
| Calor de fusión | 0.0138 kJ mol-1 |
| Calor de atomización | 0 |
| Calor de vaporización | 0.0845 kJ mol-1 |
| Energía de primera ionización | 2372.3 kJ mol-1 |
| 2ª energía de ionización | – |
| 3ª energía de ionización | – |
| Afinidad de los electrones | 0 kJ mol-1 |
| Número de oxidación mínimo | 0 |
| Min. número de oxidación común | 0 |
| Número de oxidación máximo | 0 |
| Número de oxidación común máximo | 0 |
| Electronegatividad (escala de Pauling) | – |
| Volumen de polarizabilidad | 0.198 Å3 |
| Reacción con aire | ninguna |
| Reacción con 15 M HNO3 | ninguna |
| Reacción con 6 M HCl | ninguna |
| Reacción con 6 M NaOH | ninguna |
| Óxido(s) | ninguna |
| Hidruro(s) | ninguno |
| Cloruro(s) | ninguno |
| Radio atómico | 31 pm |
| Radio iónico (ion 1+) | – |
| Radio iónico (ion 2+) | – |
| Radio iónico (ion 3+) | – |
| Radio iónico (1- ion) | – |
| Radio iónico (2- ion) | – |
| Radio iónico (3- ion) | – |
| Conductividad térmica | 0.15 W m-1 K-1 |
| Conductividad eléctrica | – |
| Punto de congelación/fusión: | -272,2 oC, 0.95 K |

Nasa: Los átomos de helio ionizados a unos 60.000 °C en la cromosfera del Sol emiten la luz ultravioleta que se ve en esta imagen.
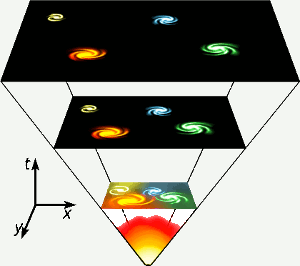
El helio se creó en los tres primeros minutos de la existencia del universo, cuando las temperaturas en todas partes eran lo suficientemente altas como para que se produjera la fusión nuclear. Esta breve fase de alta energía está representada en la parte inferior del diagrama. El helio también se produce mediante la fusión nuclear del hidrógeno en estrellas como la nuestra. Imagen: Gnixon
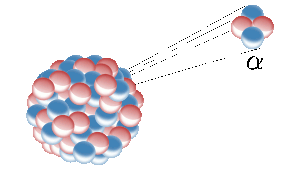
El helio en la Tierra procede de la fisión nuclear de elementos radiactivos como el uranio. Aquí un núcleo radiactivo emite un núcleo de helio (también conocido como partícula alfa). Imagen: Inductiveload

Espectro del helio con línea amarilla prominente. Imagen: Nasa

William Ramsay señalando la última columna de la tabla periódica que contiene los gases nobles (o inertes). Ramsay recibió el Premio Nobel de Química en 1904 por su trabajo en el descubrimiento de los gases inertes. Imagen: Vanity Fair
Descubrimiento del helio
La historia del descubrimiento del helio se entrelaza con el descubrimiento de la naturaleza de las estrellas.
En una época se creía que nunca se sabría de qué estaban hechas las estrellas. En 1835 el filósofo francés Auguste Comte declaró: «nunca podremos por ningún medio estudiar su composición química.» (1)
Comte pensaba que sólo podríamos saber lo que era la materia de las estrellas si podíamos llevarla al laboratorio.
A pesar del pesimismo de Comte, ya se había encontrado el método para descubrir el helio y las composiciones de las estrellas. En 1814, el físico alemán Joseph Fraunhofer había tomado el método de Isaac Newton de dividir la luz solar utilizando un prisma y había hecho un avance crucial. Fraunhofer había observado líneas oscuras en el arco iris de colores procedentes de la luz solar dividida por un prisma; las líneas que vio fueron la primera observación del espectro de una estrella. (2), (3)
En 1859/60 los científicos alemanes Gustav Kirchhoff y Robert Bunsen dieron enormes saltos en la ciencia de la espectroscopia, incluyendo el descubrimiento de que las líneas oscuras que Fraunhofer había visto eran como la huella dactilar de una sustancia.
El escenario estaba preparado para que Kirchhoff y Bunsen descubrieran nuevos elementos estudiando la luz de las sustancias cuando estaban ardiendo.
En 1860 descubrieron el cesio por sus líneas espectrales azules y en 1861 el rubidio por dos líneas espectrales rojas. Luego William Crookes descubrió el talio en 1861 tras observar una línea espectral verde brillante.
Kirchhoff y Bunsen observaron el espectro del sol y pudieron concluir que el hierro estaba presente en su atmósfera incandescente. (4)
Para el descubrimiento del helio se necesitaron algunos años más. En agosto de 1868 debía producirse el primer eclipse total desde que se publicó el trabajo de Kirchhoff y Bunsen.
El astrónomo francés Pierre Janssen estaba esperando un eclipse para poder observar las prominencias en la corona solar con un espectroscopio. En las dos semanas siguientes al eclipse, Janssen desarrolló un método para registrar los espectros de las prominencias sin necesidad de un eclipse. En estos espectros, observó una línea amarilla. (5)
La línea estaba en una posición similar pero no idéntica a las líneas del espectro del sodio. Se denominaron líneas D1 y D2. El científico inglés Norman Lockyer estudió la nueva línea amarilla; más tarde se llamaría línea D3.Publicó su estudio de la línea, consciente de que podría ser causada por un nuevo elemento:
«…así que entonces supimos que no estábamos tratando con el hidrógeno; por lo tanto, teníamos que ver con un elemento que no podíamos conseguir en nuestros laboratorios, y por lo tanto tomé la responsabilidad de acuñar la palabra helio, en primera instancia para el uso del laboratorio.» (6)
El nombre helio procedía de la palabra griega para el sol, helios.
Lockyer y Edward Frankland, su compañero de trabajo, tenían otras ideas sobre las posibles causas de la línea amarilla y, por tanto, no anunciaron un nuevo elemento.
En 1871, otros científicos estaban al tanto de la situación. Lord Kelvin discutió la «reflexión de la luz del hidrógeno y el ‘helio’ brillantes alrededor del sol». El uso de ‘helio’ va seguido de una nota a pie de página para explicarlo:
«Frankland y Lockyer encuentran que las prominencias amarillas dan una línea brillante muy decidida no muy lejos de D, pero hasta ahora no identificada con ninguna llama terrestre. Parece indicar una nueva sustancia, que proponen llamar Helio». (7)
La existencia del Helio no fue, sin embargo, aceptada por todos. (5)
Todas las dudas se disiparon cuando el químico escocés William Ramsay aisló el helio en 1895 en Londres. Ramsay había codescubierto el argón en 1894; el argón fue el primero de los gases nobles en ser descubierto. En 1895 leyó un artículo de William Hillebrand en el que se describía un gas no reactivo que se liberaba al añadir ácido al mineral de uranio, la uranita. Hillebrand creía que el gas era nitrógeno.
Ramsay, que creía que el gas podía contener argón, repitió el experimento de Hillebrand utilizando otro mineral de uranio, la cleveíta, y recogió el gas.
Su espectroscopio indicó la presencia de nitrógeno, argón y otro gas. Ramsay sospechó que podía ser helio, porque parecía haber una línea D3. (8) Consciente de que Lockyer y William Crookes tenían un espectroscopio mejor que el suyo, les envió una muestra del gas. Desgraciadamente la muestra no era adecuada, por lo que Lockyer obtuvo una muestra de uranita, extrajo el gas y lo estudió con el espectroscopio. Escribe: (8)
«Una a una las líneas desconocidas que había observado en el sol en 1868 resultaron pertenecer al gas»
El espectro del gas era idéntico al del «helio» del sol. Un nuevo elemento ganó su lugar en la tabla periódica.
Visita la página de datos sobre el helio de Chemicool.

Aspecto y características
Efectos nocivos:
No se conoce que el helio sea tóxico.
Características:
El helio es un gas ligero, inodoro, incoloro, inerte y monatómico. Puede formar moléculas diatómicas, pero sólo débilmente y a temperaturas cercanas al cero absoluto.
El helio tiene el punto de fusión más bajo de todos los elementos y su punto de ebullición es cercano al cero absoluto.
A diferencia de cualquier otro elemento, el helio no se solidifica, sino que permanece en estado líquido hasta el cero absoluto (0 K) bajo presiones ordinarias.
La voz de alguien que ha inhalado helio suena temporalmente aguda.
Usos del helio
La resonancia magnética (MRI) es el mayor usuario del helio. El helio se utiliza para enfriar los imanes superconductores de los escáneres de IRM.
El helio se utiliza para llenar globos (dirigibles) y para presurizar cohetes de combustible líquido.
Las mezclas de helio y oxígeno se utilizan como «aire» artificial para buceadores y otras personas que trabajan bajo presión. El helio se utiliza en lugar del nitrógeno del aire normal porque, después de una inmersión prolongada, el helio abandona el cuerpo más rápidamente que el nitrógeno, lo que permite una descompresión más rápida.
El helio se utiliza como escudo de gas en las proximidades de la soldadura por arco para evitar, por ejemplo, cualquier reacción de las soldaduras de metal caliente con el oxígeno. El gas se utiliza en la industria de los semiconductores para proporcionar una atmósfera inerte para el cultivo de cristales de silicio y germanio. También se utiliza como gas de alta temperatura en la producción de titanio y circonio, y como gas portador en la cromatografía de gases.
Abundancia e isótopos
Abundancia corteza terrestre: 8 partes por billón en peso, 43 partes por billón en moles
Abundancia sistema solar: 23 % en peso, 7,4 % en moles
Coste, puro: 5,2 dólares por 100g
Coste, a granel: dólares por 100g
Fuente: Casi todo el helio de la Tierra es el resultado de la desintegración radiactiva. Las principales fuentes de helio proceden de los depósitos de gas natural de los pozos de Texas, Oklahoma y Kansas. El helio se extrae por destilación fraccionada del gas natural, que contiene hasta un 7% de helio.
Isótopos: El helio tiene 8 isótopos cuyas vidas medias se conocen, con números de masa del 3 al 10. El helio natural es una mezcla de sus dos isótopos estables, el 3He y el 4He, con abundancias naturales de 0,0001% y 99,999% respectivamente.

- Auguste Comte, Cours de Philosophie Positive en el Proyecto Gutenberg
- Keith J. Laidler, The World of Physical Chemistry, 1993, p179.
- La era de la espectroscopia clásica, de MIT Spectroscopy.
- Gerard G. Emch, Mathematical and Conceptual Foundations of 20th-Century Physics., 1984, Elsevier Science Publishers, p211
- Helge Kragh, The Solar Element: A Reconsideration of Helium’s Early History., 2009, Annals of Science, 66:2, p157-182.
- J. Norman Lockyer, The Growth of our Knowledge of Helium., Science Progress, 1896, Vol 5., p249
- W. Thomson, Discurso presidencial, Asociación Británica para el Avance de la Ciencia, 1871, (Discurso. XCIX).
- Sir Norman Lockyer, The Sun’s Place in Nature., 1897, p47-48
Cite esta página
Para enlazar en línea, por favor copie y pegue uno de los siguientes:
<a href="https://www.chemicool.com/elements/helium.html">Helium</a>
o
<a href="https://www.chemicool.com/elements/helium.html">Helium Element Facts</a>
Para citar esta página en un documento académico, por favor utilice la siguiente cita que cumple con la MLA:
"Helium." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/helium.html>.