Algunos átomos son más polares que otros debido al hecho de que son más «ávidos» de electrones.
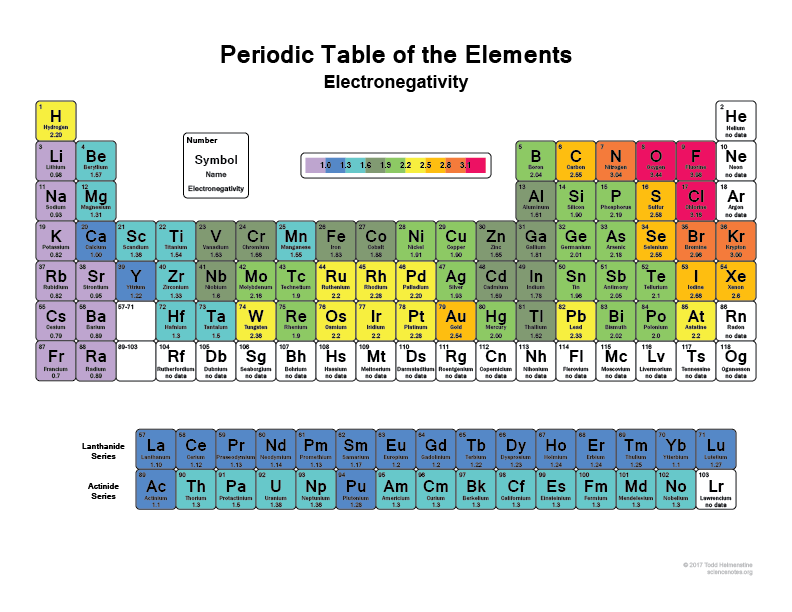
Echa un vistazo a tu tabla periódica, cuanto más a la derecha y hacia arriba vayas los átomos más electronegativos se vuelven (sin incluir los gases nobles porque tienen cáscaras completas y son «felices» y no necesitan ningún electrón de valencia).
Creo que todo el mundo ha oído que el Flúor (F), por ejemplo, es uno de los elementos más electronegativos, literalmente arrancará electrones de los átomos de Hidrógeno o de los átomos de carbono. También lo hará el Cloro (Cl)
Mira esta imagen:
Esa es la razón por la que cuando un enlace algunas moléculas tienen regiones súper polares porque tienen algo como el Hidrógeno enlazando con algo como el Flúor que básicamente tiene los electrones con él la mayor parte del tiempo.
Esta cuestión también se puede explicar por la idea de las nubes de electrones y el hecho de que los átomos más electronegativos suelen tener más electrones que permanecen con él la mayor parte del tiempo frente a los átomos no tan electronegativos.

Esto se llama el momento dipolar y sin entrar mucho en ello se ve como la mayoría de los electrones están más cerca del Oxígeno que del Hidrógeno (porque el Oxígeno es más electronegativo que el Hidrógeno)
Por cierto la palabra electronegativo suena contraintuitivo a veces pero es electro-negativo en vez de positivo porque en química los átomos que ganan electrones tienen un signo negativo (Ej: #Cl^-# es un cloro que ganó un electrón).