Obiettivi di apprendimento
- Spiegare perché i punti di ebollizione degli alcoli sono più alti di quelli degli eteri e degli alcani di massa molare simile.
- Spiegare perché gli alcoli e gli eteri con quattro o meno atomi di carbonio sono solubili in acqua mentre gli alcani simili non lo sono.
Gli alcoli possono essere considerati derivati dell’acqua (H2O; scritto anche come HOH).

Come il legame H-O-H nell’acqua, il legame R-O-H è piegato, e le molecole di alcol sono polari. Questa relazione è particolarmente evidente nelle piccole molecole e si riflette nelle proprietà fisiche e chimiche degli alcoli con bassa massa molare. La sostituzione di un atomo di idrogeno di un alcano con un gruppo OH permette alle molecole di associarsi attraverso il legame a idrogeno (Figura \PageIndex{1}}).
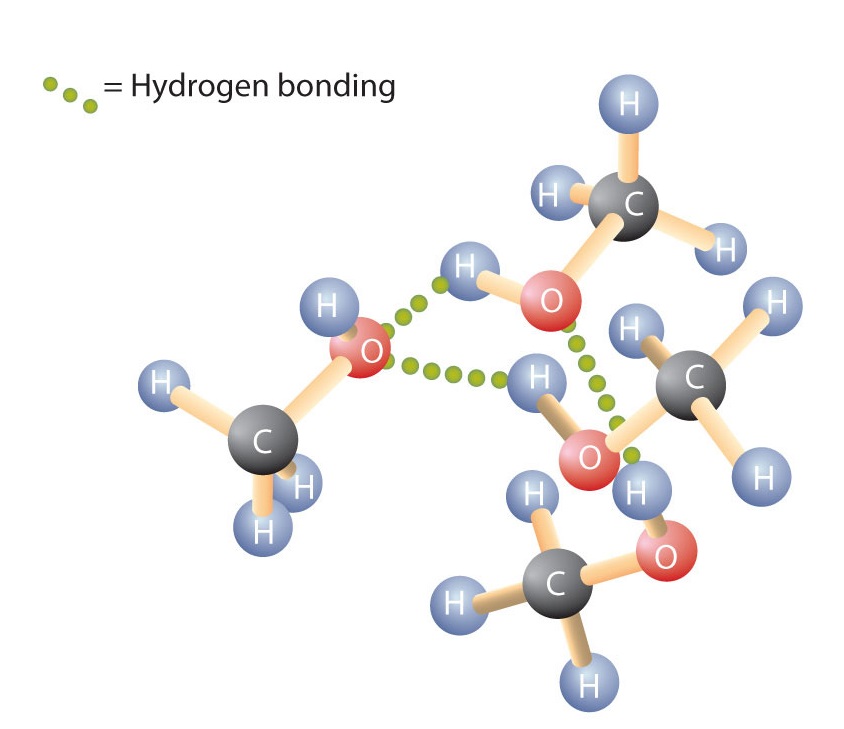
Ricordo che le proprietà fisiche sono determinate in larga misura dal tipo di forze intermolecolari. La tabella \(\PageIndex{1}}) elenca le masse molari e i punti di ebollizione di alcuni composti comuni. La tabella mostra che sostanze con masse molari simili possono avere punti di ebollizione molto diversi.
| Formula | Nome | Massa molare | Punto di ebollizione (°C) |
|---|---|---|---|
| CH4 | metano | 16 | -164 |
| HOH | acqua | 18 | 100 |
| C2H6 | ethane | 30 | -89 |
| CH3OH | metanolo | 32 | 65 |
| C3H8 | propano | 44 | 42 |
| CH3CH2OH | etanolo | 46 | 78 |
| C4H10 | butano | 58 | -1 |
| CH3CH2CH2OH | 1-propanolo | 60 | 97 |
Gli alcani sono non polari e sono quindi associati solo attraverso forze di dispersione relativamente deboli. Gli alcani con uno o quattro atomi di carbonio sono gas a temperatura ambiente. Al contrario, anche il metanolo (con un atomo di carbonio) è un liquido a temperatura ambiente. Il legame idrogeno aumenta notevolmente i punti di ebollizione degli alcoli rispetto agli idrocarburi di massa molare comparabile. Il punto di ebollizione è una misura approssimativa della quantità di energia necessaria per separare una molecola liquida dai suoi vicini più vicini. Se le molecole interagiscono attraverso il legame idrogeno, una quantità relativamente grande di energia deve essere fornita per rompere queste attrazioni intermolecolari. Solo allora la molecola può sfuggire dal liquido allo stato gassoso.
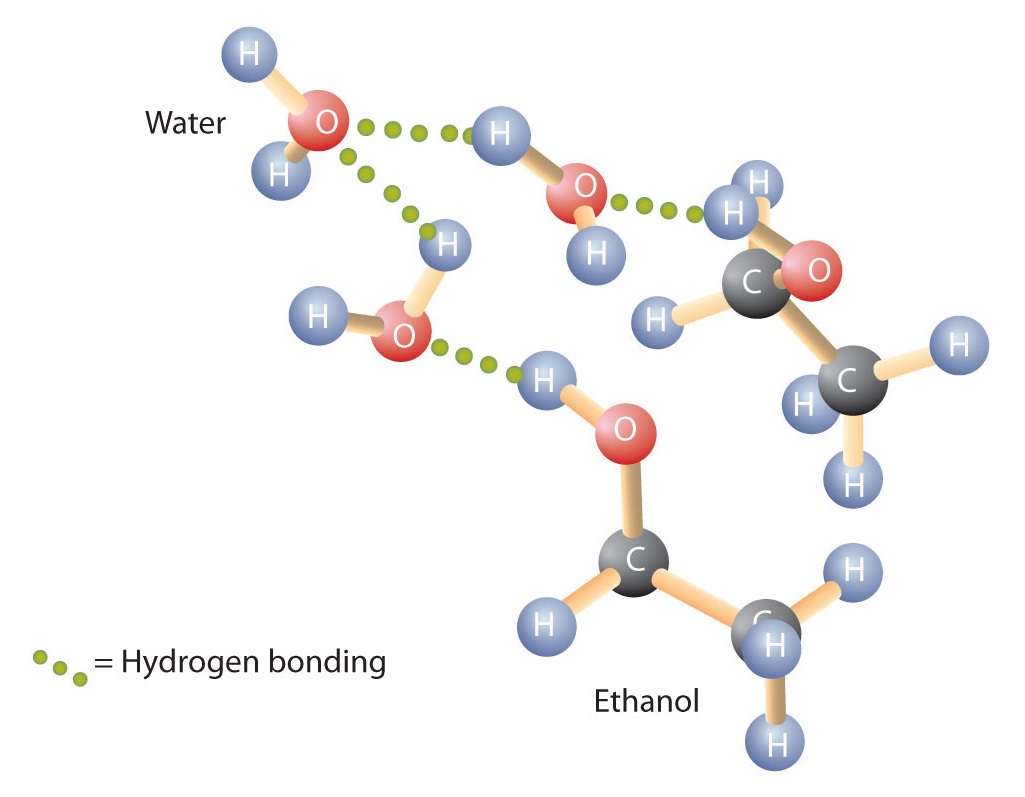
Gli alcoli possono anche impegnarsi nel legame a idrogeno con le molecole di acqua (Figura \(\PageIndex{2}). Così, mentre gli idrocarburi sono insolubili in acqua, gli alcoli con uno a tre atomi di carbonio sono completamente solubili. All’aumentare della lunghezza della catena, tuttavia, la solubilità degli alcoli in acqua diminuisce; le molecole diventano più simili agli idrocarburi e meno all’acqua. L’alcool 1-decanolo (CH3CH2CH2CH2CH2CH2CH2CH2CH2OH) è essenzialmente insolubile in acqua. Troviamo spesso che il confine della solubilità in una famiglia di composti organici si verifica a quattro o cinque atomi di carbonio.
Sommario
Gli alcoli hanno punti di ebollizione più alti di eteri e alcani di massa molare simile perché il gruppo OH permette alle molecole di alcool di impegnarsi nel legame a idrogeno. Gli alcoli con quattro o meno atomi di carbonio sono solubili in acqua perché le molecole di alcool si legano a idrogeno con le molecole d’acqua; le molecole di alcani simili non possono legarsi a idrogeno.
Esercizi di ripasso dei concetti
-
Perché l’etanolo è più solubile in acqua dell’1-esanolo?
-
Perché l’1-butanolo ha un punto di ebollizione inferiore all’1-esanolo?
Risposte
-
L’etanolo ha un gruppo OH e solo 2 atomi di carbonio; l’1-esanolo ha un gruppo OH per 6 atomi di carbonio ed è quindi più simile a un idrocarburo (non polare) di quanto lo sia l’etanolo.
-
La massa molare dell’1-esanolo è maggiore di quella dell’1-butanolo.
Esercizi
Risponete ai seguenti esercizi senza consultare le tabelle nel testo.
-
Arrangiate questi alcoli in ordine di punto di ebollizione crescente: etanolo, metanolo e 1-propanolo.
-
Che ha il punto di ebollizione più alto: butano o 1-propanolo?
-
Seleziona questi alcoli in ordine di solubilità crescente in acqua: 1-butanolo, metanolo e 1-ottanolo.
-
Ordina questi composti in ordine di crescente solubilità in acqua: 1-butanolo, etanolo e pentano.
Risposte
-
metanolo < etanolo < 1-propanolo
-
1-ottanolo < 1-butanolo < metanolo