Obiettivi di apprendimento
- Conoscere la relazione tra la forza dell’acido o della base e la grandezza di \(K_a\), \(K_b\), \(pK_a\) e \(pK_b\).
- Per capire l’effetto di livellamento.
La grandezza della costante di equilibrio per una reazione di ionizzazione può essere usata per determinare le forze relative di acidi e basi. Per esempio, l’equazione generale per la ionizzazione di un acido debole in acqua, dove HA è l’acido padre e A- è la sua base coniugata, è la seguente:
La costante di equilibrio per questa dissociazione è la seguente:
{} \etichetta{16.5.2}]
Come abbiamo notato prima, la concentrazione dell’acqua è essenzialmente costante per tutte le reazioni in soluzione acquosa, quindi \(\) nell’equazione \ref{16.5.2}} può essere incorporata in una nuova quantità, la costante di ionizzazione dell’acido (\(K_a\)), chiamata anche costante di dissociazione dell’acido:
\=\dfrac{}}
Quindi i valori numerici di K e \(K_a\) differiscono per la concentrazione dell’acqua (55,3 M). Di nuovo, per semplicità, \(H_3O^+) può essere scritto come \(H^+) nell’equazione \ref{16.5.3}}. Tieni a mente, però, che l’H^+ libero non esiste nelle soluzioni acquose e che un protone viene trasferito all’H_2O in tutte le reazioni di ionizzazione acida per formare ioni idronio, H3O^+. Più grande è il \(K_a\), più forte è l’acido e più alta è la concentrazione di \(H^+\) all’equilibrio. Come tutte le costanti di equilibrio, le costanti di ionizzazione acido-base sono effettivamente misurate in termini di attività di \(H^+\) o \(OH^-\), rendendole così senza unità. I valori di \(K_a\) per un certo numero di acidi comuni sono dati nella tabella \(\PageIndex{1}).
Le basi deboli reagiscono con l’acqua per produrre lo ione idrossido, come mostrato nella seguente equazione generale, dove B è la base madre e BH+ è il suo acido coniugato:
La costante di equilibrio per questa reazione è la costante di ionizzazione della base (Kb), chiamata anche costante di dissociazione della base:
\= \frac{}
Ancora una volta, la concentrazione dell’acqua è costante, quindi non appare nell’espressione della costante di equilibrio; invece, è inclusa nel \(K_b\). Più grande è il \(K_b\), più forte è la base e più alta è la concentrazione di \(OH^-\) all’equilibrio. I valori di \(K_b\) per un certo numero di basi deboli comuni sono dati nella tabella \PageIndex{2}\(\PageIndex{2}).
C’è una semplice relazione tra la grandezza di \(K_a\) per un acido e \(K_b\) per la sua base coniugata. Consideriamo, per esempio, la ionizzazione dell’acido cianidrico (\(HCN\)) in acqua per produrre una soluzione acida, e la reazione di \(CN^-\) con l’acqua per produrre una soluzione basica:
\
\
L’espressione della costante di equilibrio per la ionizzazione di HCN è la seguente:
{} \etichetta{16.5.8}]
L’espressione corrispondente per la reazione del cianuro con l’acqua è la seguente:
{} \etichetta{16.5.9}]
Se aggiungiamo le equazioni \(\ref{16.5.6}} e \(\ref{16.5.7), otteniamo le seguenti:
| Reazione | Costanti di equilibrio |
|---|---|
| (\cancello{HCN_{(aq)}} \H^+_{(aq)}+cancel{CN^-_{(aq)}} | (K_a=cancel{}/\cancel{}) |
| (\cancel{CN^-_{(aq)}+H_2O_{(l)} \OH^-_{(aq)}+{HCN_{(aq)}}) | \(K_b==\cancel{}/\cancel{}) |
| \(H_2O_{(l)} \H^+_{(aq)}+OH^-_{(aq)}) | \(K=K_a \volte K_b=\) |
In questo caso, la somma delle reazioni descritte da \(K_a\) e \(K_b\) è l’equazione per l’autoionizzazione dell’acqua, e il prodotto delle due costanti di equilibrio è \(K_w\):
Quindi se conosciamo o \(K_a\) per un acido o \(K_b\) per la sua base coniugata, possiamo calcolare l’altra costante di equilibrio per qualsiasi coppia acido-base coniugata.
Proprio come con \(pH\), \(pOH\), e pKw, possiamo usare logaritmi negativi per evitare la notazione esponenziale nella scrittura delle costanti di ionizzazione di acidi e basi, definendo \(pK_a\) come segue:
e \(pK_b\) come
Similmente, l’equazione \(\ref{16.5.10}), che esprime la relazione tra \(K_a\) e \(K_b\), può essere scritta in forma logaritmica come segue:
A 25 °C, questo diventa
I valori di \(pK_a\) e \(pK_b\) sono dati per diversi acidi e basi comuni nelle Tabelle \(\PageIndex{1}}) e \(\PageIndex{2}), rispettivamente, e una serie più ampia di dati è fornita nelle Tabelle E1 e E2. A causa dell’uso di logaritmi negativi, valori più piccoli di \(pK_a\) corrispondono a costanti di ionizzazione degli acidi più grandi e quindi ad acidi più forti. Per esempio, l’acido nitroso (\(HNO_2\)), con un \(pK_a\) di 3,25, è circa un milione di volte più forte dell’acido cianidrico (HCN), con un \(pK_a\) di 9,21. Al contrario, valori più piccoli di \pK_b\ corrispondono a costanti di ionizzazione di base più grandi e quindi a basi più forti.
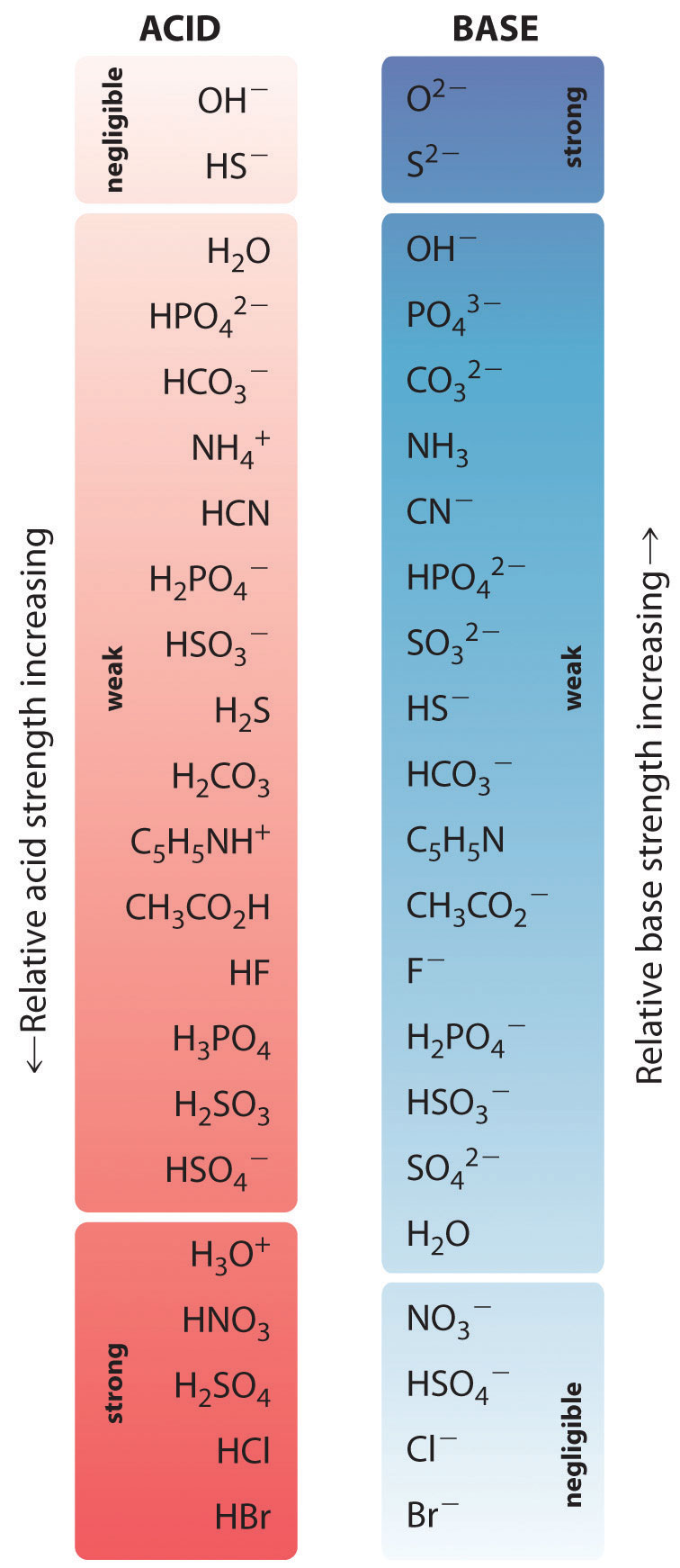
Le forze relative di alcuni acidi comuni e delle loro basi coniugate sono mostrate graficamente nella figura \(\PageIndex{1}}). Le coppie acido-base coniugate sono elencate in ordine (dall’alto al basso) di forza crescente dell’acido, che corrisponde a valori decrescenti di \(pK_a\). Questo ordine corrisponde alla forza decrescente della base coniugata o ai valori crescenti di \(pK_b\). In basso a sinistra della figura \(\PageIndex{2}) ci sono gli acidi forti comuni; in alto a destra ci sono le basi forti più comuni. Notate la relazione inversa tra la forza dell’acido padre e la forza della base coniugata. Così la base coniugata di un acido forte è una base molto debole, e la base coniugata di un acido molto debole è una base forte.
La base coniugata di un acido forte è una base debole e viceversa.
Possiamo usare le forze relative di acidi e basi per predire la direzione di una reazione acido-base seguendo un’unica regola: un equilibrio acido-base favorisce sempre la parte con l’acido e la base più deboli, come indicato da queste frecce:
\
In una reazione acido-base, il protone reagisce sempre con la base più forte.
Per esempio, l’acido cloridrico è un acido forte che si ionizza essenzialmente in una soluzione acquosa diluita per produrre \(H_3O^+) e \(Cl^-\); solo quantità trascurabili di molecole \(HCl) rimangono non associate. Quindi l’equilibrio di ionizzazione si trova virtualmente tutto a destra, come rappresentato da una singola freccia:
Al contrario, l’acido acetico è un acido debole, e l’acqua è una base debole. Di conseguenza, le soluzioni acquose di acido acetico contengono principalmente molecole di acido acetico in equilibrio con una piccola concentrazione di \(H_3O^+\) e ioni acetato, e l’equilibrio di ionizzazione si trova molto a sinistra, come rappresentato da queste frecce:
\
Similmente, nella reazione di ammoniaca con acqua, lo ione idrossido è una base forte, e l’ammoniaca è una base debole, mentre lo ione ammonio è un acido più forte dell’acqua. Quindi anche questo equilibrio si trova a sinistra:
\
Tutti gli equilibri acido-base favoriscono il lato con l’acido e la base più deboli. Così il protone è legato alla base più forte.
Esempio \(\PageIndex{1}}): Ioni butirrato e dimetilammonio
- Calcolare \(K_b\) e \(pK_b\) dello ione butirrato (\(CH_3CH_2CH_2CO_2^-\)). Il \(pK_a\) dell’acido butirrico a 25°C è 4,83. L’acido butirrico è responsabile del cattivo odore del burro rancido.
- Calcolare \(K_a\) e \(pK_a\) dello ione dimetilammonio (\((CH_3)_2NH_2^+\)). La costante di ionizzazione di base \(K_b\) della dimetilammina (\((CH_3)_2NH\)) è \(5,4 \volte 10^{-4}\ a 25°C.
Data: \(pK_a\) e \(K_b\)
Chiesto: \(K_b\) e \(pK_b\) corrispondenti, \(K_a\) e \(pK_a\)
Strategia:
Le costanti \(K_a\) e \(K_b\) sono correlate come mostrato nell’equazione \(\ref{16.5.10}\). Le costanti \(pK_a\) e \(pK_b\) per un acido e la sua base coniugata sono correlate come mostrato nelle equazioni \(\ref{16.5.15}\) e \(\ref{16.5.16}). Usa le relazioni pK = -log K e K = 10-pK (Equazioni \(\ref{16.5.11}} e \(\ref{16.5.13})) per convertire tra \(K_a\) e \(pK_a\) o \(K_b\) e \(pK_b\).
Soluzione:
Ci viene data la \(pK_a\) per l’acido butirrico e ci viene chiesto di calcolare la \(K_b\) e la \(pK_b\) per la sua base coniugata, lo ione butirrato. Poiché il valore \(pK_a\) citato è per una temperatura di 25°C, possiamo usare l’equazione \(\ref{16.5.16}\): \(pK_a\) + \(pK_b\) = pKw = 14.00. Sostituendo il \(pK_a\) e risolvendo il \(pK_b\),
Poiché \(pK_b = -\log K_b\), \(K_b\) è \(10^{-9,17} = 6,8 \volte 10^{-10}\).
In questo caso, ci viene dato \(K_b\) per una base (dimetilammina) e ci viene chiesto di calcolare \(K_a\) e \(pK_a\) per il suo acido coniugato, lo ione dimetilammonio. Poiché la quantità iniziale data è \(K_b\) piuttosto che \(pK_b\), possiamo usare l’equazione \(\ref{16.5.10}\): \(K_aK_b = K_w\). Sostituendo i valori di \(K_b\) e \(K_w\) a 25°C e risolvendo per \(K_a\),
Poiché \(pK_a\) = -log \(K_a\), abbiamo \(pK_a = -log(1,9 volte 10^{-11}) = 10,72\). Avremmo anche potuto convertire \(K_b\) in \(pK_b\) per ottenere la stessa risposta:
Se ci viene data una qualsiasi di queste quattro quantità per un acido o una base (\(K_a\), \(pK_a\), \(K_b\), o \(pK_b\)), possiamo calcolare le altre tre.
Esercizio \(\PageIndex{1}}): Acido lattico
L’acido lattico (\(CH_3CH(OH)CO_2H\)) è responsabile del sapore e dell’odore pungente del latte acido; si pensa anche che produca indolenzimento nei muscoli affaticati. Il suo \(pK_a\) è 3,86 a 25°C. Calcola \(K_a\) per l’acido lattico e \(pK_b\) e \(K_b\) per lo ione lattato.
Risposta
- \(K_a = 1,4 volte 10^{-4}\ per l’acido lattico;
- \(pK_b\) = 10.14 e
- \(K_b = 7,2 volte 10^{-11}\ per lo ione lattato
Soluzioni di acidi e basi forti: L’effetto livellamento
Si noterà nella tabella (\PageIndex{1}) che acidi come \(H_2SO_4\) e \(HNO_3\) si trovano sopra lo ione idronio, il che significa che hanno valori \(pK_a\) minori di zero e sono acidi più forti dello ione \(H_3O^+\). Ricordiamo dal capitolo 4 che il protone acido in quasi tutti gli oxoacidi è legato a uno degli atomi di ossigeno dell’oxoanione. Così l’acido nitrico dovrebbe essere scritto correttamente come \(HONO_2\). Sfortunatamente, però, le formule degli ossiacidi sono quasi sempre scritte con l’idrogeno a sinistra e l’ossigeno a destra, dando invece \(HNO_3\). Infatti, tutti e sei i comuni acidi forti che abbiamo incontrato per la prima volta nel Capitolo 4 hanno valori \(pK_a\) inferiori a zero, il che significa che hanno una maggiore tendenza a perdere un protone rispetto allo ione \(H_3O^+). Al contrario, le basi coniugate di questi acidi forti sono basi più deboli dell’acqua. Di conseguenza, gli equilibri di trasferimento di protoni per questi acidi forti si trovano molto a destra, e l’aggiunta di uno qualsiasi degli acidi forti comuni all’acqua provoca una reazione essenzialmente stechiometrica dell’acido con l’acqua per formare una soluzione dello ione \(H_3O^+\) e la base coniugata dell’acido.
Anche se \(K_a\) per \(HI\) è circa 108 più grande di \(K_a\) per \(HNO_3\), la reazione di \(HI\) o \(HNO_3\) con acqua dà una soluzione essenzialmente stechiometrica di \(H_3O^+\) e I- o \(NO_3^-\). Infatti, una soluzione acquosa 0,1 M di qualsiasi acido forte contiene effettivamente 0,1 M \(H_3O^+), indipendentemente dall’identità dell’acido forte. Questo fenomeno è chiamato effetto di livellamento: ogni specie che è un acido più forte dell’acido coniugato dell’acqua (\(H_3O^+)) è livellato alla forza di \(H_3O^+) in soluzione acquosa perché \(H_3O^+) è l’acido più forte che può esistere in equilibrio con l’acqua. Di conseguenza, è impossibile distinguere tra le forze di acidi come HI e HNO3 in soluzione acquosa, e un approccio alternativo deve essere utilizzato per determinare le loro forze acide relative.
Un metodo è quello di utilizzare un solvente come l’acido acetico anidro. Poiché l’acido acetico è un acido più forte dell’acqua, deve essere anche una base più debole, con una minore tendenza ad accettare un protone rispetto a \(H_2O\). Le misure della conducibilità di soluzioni 0,1 M sia di HI che di \(HNO_3\) in acido acetico mostrano che HI è completamente dissociato, ma \(HNO_3\) è solo parzialmente dissociato e si comporta come un acido debole in questo solvente. Questo risultato ci dice chiaramente che HI è un acido più forte di \(HNO_3\). L’ordine relativo delle forze degli acidi e i valori approssimativi di \K_a\ e \pK_a\ per gli acidi forti in cima alla tabella \(\PageIndex{1}) sono stati determinati usando misure come questa e diversi solventi non acquosi.
In soluzioni acquose, \(H_3O^+\) è l’acido più forte e \(OH^-\) è la base più forte che può esistere in equilibrio con \(H_2O\).
L’effetto livellamento si applica anche a soluzioni di basi forti: In soluzione acquosa, qualsiasi base più forte di OH- è livellata alla forza di OH- perché OH- è la base più forte che può esistere in equilibrio con l’acqua. Sali come \(K_2O\), \(NaOCH_3\) (metossido di sodio), e \(NaNH_2\) (sodamide, o ammide di sodio), i cui anioni sono le basi coniugate di specie che starebbero sotto l’acqua nella tabella \(\PageIndex{2}}), sono tutte basi forti che reagiscono essenzialmente completamente (e spesso violentemente) con l’acqua, accettando un protone per dare una soluzione di \(OH^-\) e il catione corrispondente:
Altri esempi che si possono incontrare sono l’idruro di potassio (\(KH\)) e composti organometallici come il litio metile (\(CH_3Li\)).
Acidi e basi poliprotiche
Come hai imparato, gli acidi poliprotici come \(H_2SO_4\), \(H_3PO_4\), e \(H_2CO_3\) contengono più di un protone ionizzabile, e i protoni sono persi in modo graduale. La specie completamente protonata è sempre l’acido più forte perché è più facile rimuovere un protone da una molecola neutra che da uno ione caricato negativamente. Così la forza dell’acido diminuisce con la perdita di protoni successivi, e, corrispondentemente, il \(pK_a\) aumenta. Considera \(H_2SO_4\), per esempio:
L’equilibrio nella prima reazione sta molto a destra, coerente con \(H_2SO_4\) che è un acido forte. Al contrario, nella seconda reazione, quantità apprezzabili di entrambi \(HSO_4^-\) e \(SO_4^{2-}\ sono presenti all’equilibrio.
Per un acido poliprotico, la forza dell’acido diminuisce e il \(pK_a\) aumenta con la perdita sequenziale di ogni protone.
Lo ione idrogeno solfato (\(HSO_4^-\)) è sia la base coniugata di \(H_2SO_4\) che l’acido coniugato di \(SO_4^{2-}). Proprio come l’acqua, HSO4- può quindi agire sia come acido che come base, a seconda che l’altro reagente sia un acido o una base più forte. Al contrario, lo ione solfato (\(SO_4^{2-}-)) è una base poliprotica che è in grado di accettare due protoni in modo graduale:
Come qualsiasi altra coppia acido-base coniugata, le forze degli acidi e delle basi coniugate sono correlate da \(pK_a\) + \(pK_b\) = pKw. Consideriamo, per esempio, la coppia acido-base coniugata \(HSO_4^-/ SO_4^{2-}). Dalla tabella \PageIndex{1}, vediamo che la \pK_a\ di \(HSO_4^-\) è 1,99. Quindi la \pK_b\ di \(SO_4^{2-}- è 14.00 – 1.99 = 12.01. Così il solfato è una base piuttosto debole, mentre \(OH^-\) è una base forte, quindi l’equilibrio mostrato nell’equazione \(\ref{16.6}\ è a sinistra. Lo ione \(HSO_4^-) è anche una base molto debole (\(pK_a) di \(H_2SO_4\) = 2.0, \(pK_b) di \(HSO_4^- = 14 – (-2.0) = 16\)), che è coerente con quello che ci aspettiamo per la base coniugata di un acido forte.
Esempio \(\PageIndex{2})
Predite se l’equilibrio per ogni reazione sta a sinistra o a destra come scritto.
- \(NH^+_{4(aq)}+PO^{3-}_{4(aq)} \rightleftharpoons NH_{3(aq)}+HPO^{2−}_{4(aq)}\)
- \(CH_3CH_2CO_2H_{(aq)}+CN^−_{(aq)} \rightleftharpoons CH_3CH_2CO^-_{2(aq)}+HCN_{(aq)})
Data: equazione chimica bilanciata
Chiesto: posizione di equilibrio
Strategia:
Identificare le coppie acido-base coniugate in ogni reazione. Poi fai riferimento alle tabelle \(\PageIndex{1})e \(\PageIndex{2})e alla figura \(\PageIndex{2})per determinare quale sia l’acido e la base più forti. L’equilibrio favorisce sempre la formazione della coppia acido-base più debole.
Soluzione:
Le coppie acido-base coniugate sono \(NH_4^+/NH_3\) e \(HPO_4^{2-}/PO_4^{3-}). Secondo le tabelle \(\PageIndex{1}} e \(\PageIndex{2}), \(NH_4^+\) è un acido più forte (\(pK_a = 9.25)) rispetto a \(HPO_4^{2-}) (pKa = 12.32), e \(PO_4^{3-}) è una base più forte (\(pK_b = 1.68)) di \(NH_3) (\(pK_b = 4.75)). L’equilibrio sarà quindi a destra, favorendo la formazione della coppia acido-base più debole:
Le coppie acido-base coniugate sono \(CH_3CH_2CO_2H/CH_3CH_2CO_2^-\) e \(HCN/CN^-\). Secondo la Tabella \PageIndex{1}, HCN è un acido debole (pKa = 9.21) e \(CN^-\) è una base moderatamente debole (pKb = 4.79). L’acido propionico (\(CH_3CH_2CO_2H\)) non è elencato nella tabella \PageIndex{1}}, comunque. In una situazione come questa, l’approccio migliore è quello di cercare un composto simile le cui proprietà acido-base sono elencate. Per esempio, l’acido propionico e l’acido acetico sono identici tranne che per i gruppi attaccati all’atomo di carbonio dell’acido carbossilico (\ce{-CH_2CH_3}\ contro \ce{-CH_3}\)), quindi potremmo aspettarci che i due composti abbiano proprietà acido-base simili. In particolare, ci aspetteremmo che il \(pK_a\) dell’acido propionico sia simile in grandezza al \(pK_a\) dell’acido acetico. (Infatti, il \(pK_a\) dell’acido propionico è 4,87, rispetto a 4,76 per l’acido acetico, il che rende l’acido propionico un acido leggermente più debole dell’acido acetico). Quindi l’acido propionico dovrebbe essere un acido significativamente più forte di \(HCN\). Poiché l’acido più forte forma la base coniugata più debole, prevediamo che il cianuro sarà una base più forte del propionato. L’equilibrio sarà quindi a destra, favorendo la formazione della coppia acido-base più debole:
Esercizio \(\PageIndex{1})
Predici se l’equilibrio per ogni reazione è a sinistra o a destra come scritto.
- (H_2O_{(l)}+HS^-_{(aq)} \rightleftharpoons OH^−_{(aq)}+H_2S_{(aq)}\)
- \(HCO^−_{2(aq)}+HSO^−_{4(aq)} \HCO_2H_{(aq)}+SO^{2-}_{4(aq)})
Risposta a
sinistra
Risposta b
sinistra
Sommario
Le reazioni acido-base contengono sempre due coppie acido-base coniugate. Ogni acido e ogni base ha una costante di ionizzazione associata che corrisponde alla sua forza di acido o di base. Due specie che differiscono solo di un protone costituiscono una coppia acido-base coniugata. La grandezza della costante di equilibrio per una reazione di ionizzazione può essere usata per determinare le forze relative di acidi e basi. Per una soluzione acquosa di un acido debole, la costante di dissociazione è chiamata costante di ionizzazione dell’acido (\(K_a\)). Allo stesso modo, la costante di equilibrio per la reazione di una base debole con l’acqua è la costante di ionizzazione della base (\(K_b\)). Per qualsiasi coppia acido-base coniugata, \(K_aK_b = K_w\). Valori più piccoli di \(pK_a\) corrispondono a costanti di ionizzazione dell’acido più grandi e quindi ad acidi più forti. Al contrario, valori più piccoli di \(pK_b\) corrispondono a costanti di ionizzazione delle basi più grandi e quindi a basi più forti. A 25°C, \(pK_a + pK_b = 14,00\). Le reazioni acido-base procedono sempre nella direzione che produce la coppia acido-base più debole. Nessun acido più forte di \(H_3O^+\) e nessuna base più forte di \(OH^-\) può esistere in soluzione acquosa, portando al fenomeno noto come effetto livellamento. Gli acidi (e le basi) poliprotici perdono (e guadagnano) protoni in modo graduale, con la specie completamente protonata che è l’acido più forte e la specie completamente deprotonata la base più forte.
Equazioni chiave
- Costante di ionizzazione degli acidi: \=dfrac{}{}
- Costante di ionizzazione della base: \= \dfrac{}{}
- Relazione tra \(K_a\) e \(K_b\) di una coppia acido-base coniugata: \
- Definizione di \(pK_a\): \
- Definizione di \(pK_b\): \ \
- Relazione tra \(pK_a\) e \(pK_b\) di una coppia acido-base coniugata: \ \
Contribuenti e attribuzioni
-
Stephen Lower, professore emerito (Simon Fraser U.) Chem1 Virtual Textbook