Il modello atomico
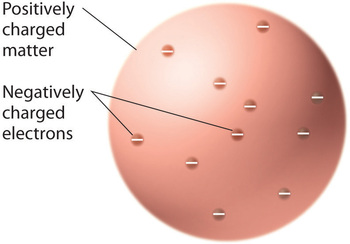
Una volta che gli scienziati conclusero che tutta la materia contiene elettroni con carica negativa, divenne chiaro che gli atomi, che sono elettricamente neutri, devono contenere anche cariche positive per bilanciare quelle negative. Thomson propose che gli elettroni fossero incorporati in una sfera uniforme che conteneva sia la carica positiva che la maggior parte della massa dell’atomo, un po’ come l’uvetta nel budino di prugne o le gocce di cioccolato in un biscotto (Figura \PageIndex{9})
2.4.6
Figura \PageIndex{9}): Modello di Thomson del budino di prugne o biscotto al cioccolato dell’atomo. In questo modello, gli elettroni sono incorporati in una sfera uniforme di carica positiva. Immagine usata con il permesso (CC BY-SA-NC).
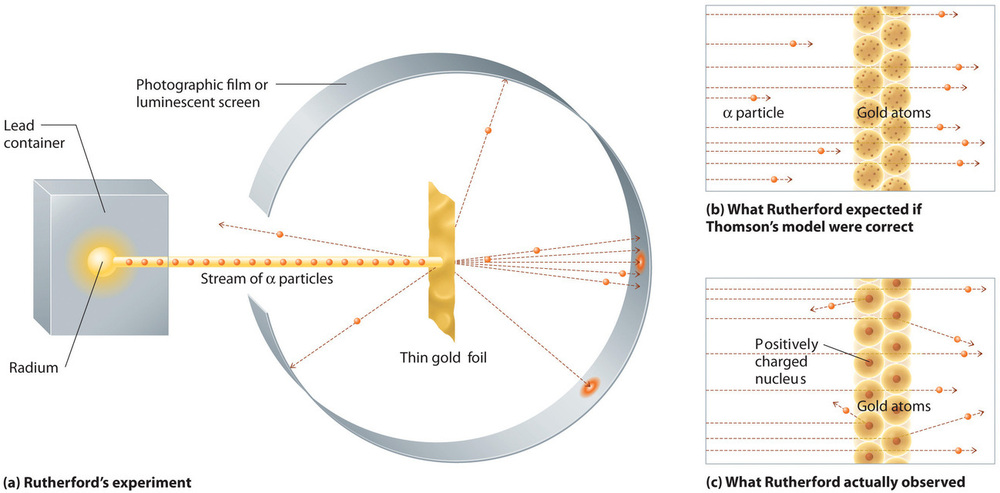
In un unico famoso esperimento, tuttavia, Rutherford dimostrò inequivocabilmente che il modello dell’atomo di Thomson era sbagliato. Rutherford puntò un flusso di particelle α su un bersaglio di lamina d’oro molto sottile (Figura \PageIndex{10a}) ed esaminò come le particelle α venivano disperse dalla lamina. L’oro è stato scelto perché potrebbe essere facilmente martellato in fogli estremamente sottili, minimizzando il numero di atomi nel bersaglio. Se il modello di Thomson dell’atomo fosse corretto, le particelle α cariche positivamente dovrebbero schiantarsi attraverso la massa uniformemente distribuita del bersaglio d’oro come palle di cannone attraverso il lato di una casa di legno. Potrebbero muoversi un po’ più lentamente quando emergono, ma dovrebbero passare essenzialmente dritte attraverso il bersaglio (Figura \PageIndex{10b}). Per lo stupore di Rutherford, una piccola frazione delle particelle α fu deviata con grandi angoli, e alcune furono riflesse direttamente alla fonte (Figura \PageIndex{10c}). Secondo Rutherford, “Era quasi incredibile come se tu sparassi un proiettile di 15 pollici contro un pezzo di carta velina e questo tornasse indietro e ti colpisse.”
2.4.7
Figura \(\PageIndex{10}): Un riassunto degli esperimenti di Rutherford. (a) Una rappresentazione dell’apparato usato da Rutherford per rilevare le deflessioni in un flusso di particelle α puntate su un bersaglio di lamina d’oro sottile. Le particelle erano prodotte da un campione di radio. (b) Se il modello di Thomson dell’atomo fosse corretto, le particelle α avrebbero dovuto passare direttamente attraverso la lamina d’oro. (c) Tuttavia, un piccolo numero di particelle α è stato deviato in varie direzioni, compreso il ritorno alla sorgente. Questo potrebbe essere vero solo se la carica positiva fosse molto più massiccia della particella α. Suggerì che la massa dell’atomo d’oro è concentrata in una regione molto piccola dello spazio, che chiamò nucleo. Immagine usata con il permesso (CC BY-SA-NC).
I risultati di Rutherford non erano coerenti con un modello in cui la massa e la carica positiva sono distribuite uniformemente in tutto il volume di un atomo. Invece, suggerivano fortemente che sia la massa che la carica positiva sono concentrate in una piccola frazione del volume di un atomo, che Rutherford chiamava nucleo. Aveva senso che una piccola frazione delle particelle α si scontrasse con i nuclei densi e caricati positivamente, sia di striscio, provocando grandi deviazioni, sia quasi frontalmente, facendole riflettere direttamente alla fonte.
Anche se Rutherford non riusciva a spiegare perché le repulsioni tra le cariche positive nei nuclei che contenevano più di una carica positiva non causassero la disintegrazione del nucleo, egli ragionava sul fatto che le repulsioni tra gli elettroni caricati negativamente avrebbero causato la distribuzione uniforme degli elettroni in tutto il volume dell’atomo.Oggi si sa che le forze nucleari forti, che sono molto più forti delle interazioni elettrostatiche, tengono insieme i protoni e i neutroni nel nucleo. Per questa e altre intuizioni, Rutherford ricevette il premio Nobel per la chimica nel 1908. Sfortunatamente, Rutherford avrebbe preferito ricevere il Premio Nobel per la Fisica perché considerava la fisica superiore alla chimica. Secondo la sua opinione, “Tutta la scienza è o fisica o collezionismo di francobolli.”
 2.4.8
2.4.8
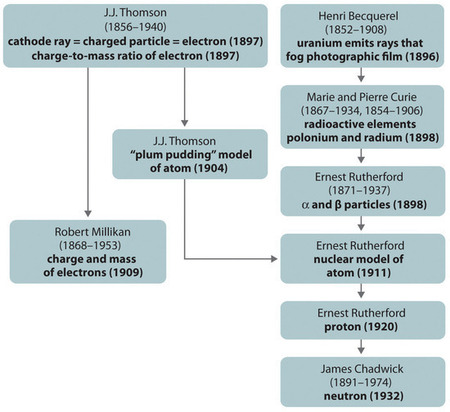
Figura \(\PageIndex{11}): Un riassunto dello sviluppo storico dei modelli dei componenti e della struttura dell’atomo. Le date tra parentesi sono gli anni in cui sono stati eseguiti gli esperimenti chiave. Immagine usata con il permesso (CC BY-SA-NC).
Lo sviluppo storico dei diversi modelli della struttura dell’atomo è riassunto in (Figura \(\PageIndex{11}) Rutherford stabilì che il nucleo dell’atomo di idrogeno era una particella con carica positiva, per la quale coniò il nome di protone nel 1920. Suggerì anche che i nuclei degli elementi diversi dall’idrogeno dovevano contenere particelle elettricamente neutre con circa la stessa massa del protone. Il neutrone, tuttavia, non fu scoperto fino al 1932, quando James Chadwick (1891-1974, studente di Rutherford; premio Nobel per la fisica, 1935) lo scoprì. Come risultato del lavoro di Rutherford, divenne chiaro che una particella α contiene due protoni e neutroni, ed è quindi il nucleo di un atomo di elio.
2.4.9
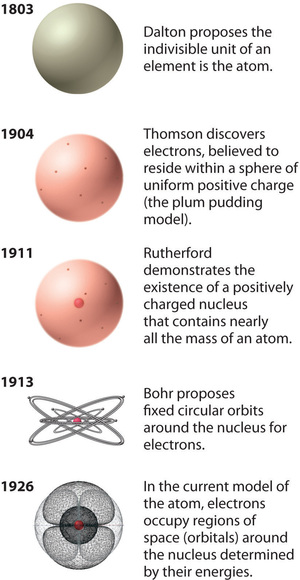
Figura \(\PageIndex{12}): L’evoluzione della teoria atomica, come illustrato dai modelli dell’atomo di ossigeno. Il modello di Bohr e quello attuale sono descritti nel Capitolo 6, “La struttura degli atomi”. Immagine usata con il permesso (CC BY-SA-NC).
Il modello dell’atomo di Rutherford è essenzialmente lo stesso del modello moderno, tranne che ora si sa che gli elettroni non sono distribuiti uniformemente nel volume dell’atomo. Invece, sono distribuiti secondo una serie di principi descritti dalla Meccanica Quantistica. La figura \PageIndex{12} mostra come il modello dell’atomo si sia evoluto nel tempo dall’unità indivisibile di Dalton alla visione moderna insegnata oggi.