Autoregolazione del flusso sanguigno cerebrale
L’autoregolazione del flusso sanguigno cerebrale è la capacità del cervello di mantenere il flusso sanguigno relativamente costante nonostante i cambiamenti nella pressione di perfusione. L’autoregolazione è presente in molti letti vascolari, ma è particolarmente ben sviluppata nel cervello, probabilmente a causa della necessità di un apporto costante di sangue e di omeostasi dell’acqua. Negli adulti normotesi, il flusso sanguigno cerebrale è mantenuto a ~ 50 mL per 100 g di tessuto cerebrale al minuto, a condizione che CPP è nel range di ~ 60 a 160 mmHg . Al di sopra e al di sotto di questo limite, l’autoregolazione si perde e il flusso sanguigno cerebrale diventa dipendente dalla pressione arteriosa media in modo lineare. Quando la CPP scende al di sotto del limite inferiore dell’autoregolazione, si verifica un’ischemia cerebrale. La riduzione del flusso sanguigno cerebrale è compensata da un aumento dell’estrazione di ossigeno dal sangue. Segni clinici o sintomi di ischemia non sono visti fino a quando la diminuzione della perfusione supera la capacità dell’aumento dell’estrazione di ossigeno per soddisfare le esigenze metaboliche. A questo punto, i segni clinici di ipoperfusione si verificano, tra cui vertigini, stato mentale alterato, e, infine, danni irreversibili ai tessuti (infarto).
I meccanismi di autoregolazione nel cervello non sono completamente compresi e probabilmente differiscono con aumenti o diminuzioni di pressione. Anche se un ruolo per il coinvolgimento neuronale in autoregolazione è attraente, gli studi hanno dimostrato che l’autoregolazione del flusso sanguigno cerebrale è conservato in animali simpaticamente e parasimpaticamente denervato, indicando che un contributo importante dei fattori neurogenici estrinseci per autoregolazione del flusso sanguigno cerebrale è improbabile (vedi innervazione perivascolare). Recentemente, un ruolo per l’ossido nitrico neuronale nella modulazione del flusso sanguigno cerebrale autoregolazione è stato dimostrato, suggerendo che anche se l’innervazione estrinseca non può essere coinvolto, innervazione intrinseca può avere un ruolo. Anche i biprodotti del metabolismo sono stati proposti per avere un ruolo nell’autoregolazione. Le riduzioni del flusso sanguigno cerebrale stimolano il rilascio di sostanze vasoattive dal cervello che causano la dilatazione delle arterie. I candidati per queste sostanze vasoattive includono H+, K+, O2, adenosina e altri. L’autoregolazione del flusso sanguigno cerebrale quando la pressione fluttua all’estremità alta della curva autoregolatoria è molto probabilmente dovuto al comportamento miogenico della muscolatura liscia cerebrale che si contrae in risposta alla pressione elevata e si dilata in risposta alla pressione diminuita. L’importante contributo dell’attività miogenica all’autoregolazione è dimostrato in vitro in arterie cerebrali isolate e pressurizzate che si contraggono in risposta all’aumento della pressione e si dilatano in risposta alla diminuzione della pressione (vedi Risposta miogenica). L’autoregolazione a pressioni inferiori al range di pressione miogenica probabilmente coinvolge ipossia e il rilascio di fattori metabolici.
L’importanza della autoregolazione nella normale funzione del cervello è evidenziato dal fatto che il danno cerebrale significativo si verifica quando i meccanismi di autoregolazione vengono persi. Per esempio, durante l’ipertensione acuta a pressioni superiori al limite autoregolatore, la costrizione miogenica della muscolatura liscia vascolare è superata dall’eccessiva pressione intravascolare e si verifica una dilatazione forzata dei vasi cerebrali. La perdita di tono miogenico durante la dilatazione forzata diminuisce la resistenza cerebrovascolare, un risultato che può produrre un grande aumento del flusso sanguigno cerebrale (300-400%), noto come breakthrough autoregolatorio (Figura 16). Inoltre, la diminuzione della resistenza cerebrovascolare aumenta la pressione idrostatica sull’endotelio cerebrale, causando la formazione di edema, la causa alla base di condizioni come l’encefalopatia ipertensiva, la sindrome da encefalopatia reversibile posteriore (PRES), ed eclampsia (vedi Formazione di edema vasogenico).
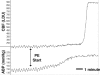
FIGURA 16
Tracciamento di CBF (in unità Doppler laser) e ABP (in mmHg) in risposta a dosi crescenti di PE. In questo esperimento, CBF è aumentato quattro volte maggiore rispetto alla linea di base come ABP aumentato da 140 a 210 mmHg, dimostrando rottura autoregolatoria. Usato (più…)
Anche se non comune dall’avvento della terapia antipertensiva efficace, encefalopatia ipertensiva si verifica come risultato di un improvviso, sostenuto aumento della pressione sanguigna sufficiente a superare il limite superiore di autoregolazione del flusso sanguigno cerebrale (>160 mmHg) . I primi studi sulla reazione dei vasi cerebrali all’alta pressione sanguigna hanno prodotto il concetto di vasospasmo ipertensivo. L’encefalopatia ipertensiva acuta è stata pensata come il risultato dello spasmo – definito come una vasocostrizione incontrollata – delle arterie cerebrali, causando l’ischemia del tessuto cerebrale. Questo concetto ha avuto origine dalle osservazioni di Byrom che ha prodotto un’ipertensione renale sperimentale e ha scoperto che ~90% dei ratti ipertesi con manifestazioni neurologiche hanno mostrato macchie corticali multiple di stravaso blu trypan, mentre i ratti senza sintomi cerebrali sembravano avere una normale permeabilità cerebrovascolare. Egli notò anche ciò che chiamò un’alternanza di vasocostrizione/vasodilatazione nei vasi piali, un fenomeno noto come aspetto “a salsicciotto”. Questa osservazione lo ha portato alla conclusione che il vasospasmo cerebrale ha causato l’ischemia e la formazione di edema in risposta all’ipertensione acuta. Byrom in seguito modificò il suo punto di vista e si riferì a una scoperta nella circolazione mesenterica che i vasi con questo aspetto di “salsiccia-stringa” avevano perdite di proteine solo nelle parti dilatate dei vasi. Da allora, è stato stabilito che l’alta pressione sanguigna provoca un aumento del flusso sanguigno cerebrale e “rottura dell’autoregolazione”. Ulteriori esperimenti hanno confermato che la perdita di vasocostrizione miogenica durante la dilatazione forzata piuttosto che lo spasmo è l’evento critico nell’encefalopatia ipertensiva.