L’elemento chimico elio è classificato come un gas nobile e un non metallo. Fu scoperto nel 1895 da William Ramsay.

Data Zone
| Classificazione: | L’elio è un gas nobile e un non metallo |
| Colore: | incolore |
| Peso atomico: | 4.00260 |
| Stato: | gas |
| Punto di fusione: | -272.2 oC, 0.95 K |
| Nota: Alla normale pressione atmosferica, l’elio non si solidifica e quindi non ha punto di fusione. Il punto di fusione citato sopra è sotto una pressione di 25 atmosfere. | |
| Punto di ebollizione: | -268.9 oC, 4.2 K |
| Elettroni: | 2 |
| Protoni: | 2 |
| Neutroni nel più abbondante isotopo: | 2 |
| Gusci di elettroni: | 2 |
| Configurazione degli elettroni: | 1s2 |
| Densità @ 20oC: | 0.0001787 g/cm3 |
Mostra di più, incluso: Calori, Energie, Ossidazione,
Reazioni, Composti, Raggi, Conducibilità
| Volume atomico: | 27,2 cm3/mol |
| Struttura: | solitamente esagonale a pacchi ravvicinati |
| (v.alta pressione necessaria per solidificare l’elio) | |
| Capacità termica specifica | 5,193 J g-1 K-1 |
| Calore di fusione | 0.0138 kJ mol-1 |
| Calore di atomizzazione | 0 |
| Calore di vaporizzazione | 0.0845 kJ mol-1 |
| 1a energia di ionizzazione | 2372.3 kJ mol-1 |
| 2a energia di ionizzazione | – |
| 3a energia di ionizzazione | – |
| Effettività degli elettroni | 0 kJ mol-1 |
| Numero minimo di ossidazione | 0 |
| Min. numero di ossidazione comune | 0 |
| Numero massimo di ossidazione | 0 |
| Numero massimo di ossidazione comune | 0 |
| Elettronegatività (Scala Pauling) | – |
| Volume di polarizzabilità | 0.198 Å3 |
| Reazione con aria | nessuna |
| Reazione con 15 M HNO3 | nessuna |
| Reazione con 6 M HCl | nessuno |
| Reazione con 6 M NaOH | nessuno |
| Ossido(i) | nessuno |
| Idruri | – |
| Raggio ionico (ione 2+) | – |
| Raggio ionico (ione 3+) | – |
| Raggio ionico (1- ione) | – |
| Raggio ionico (2- ione) | – |
| Raggio ionico (3-ione) | – |
| Conduttività termica | 0.15 W m-1 K-1 |
| Conducibilità elettrica | – |
| Punto di congelamento/fusione: | -272.2 oC, 0.95 K |

Nasa: atomi di elio ionizzati a circa 60.000 °C nella cromosfera del Sole emettono la luce ultravioletta vista in questa immagine.
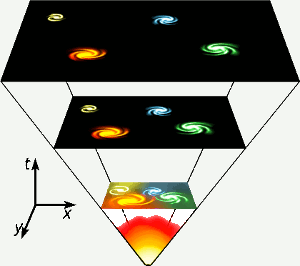
L’elio è stato prodotto nei primi tre minuti dell’esistenza dell’universo, quando ovunque le temperature erano abbastanza alte da permettere la fusione nucleare. Questa breve fase ad alta energia è rappresentata nella parte inferiore del diagramma. L’elio è anche prodotto dalla fusione nucleare dell’idrogeno in stelle come la nostra. Immagine: Gnixon
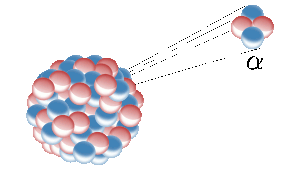
L’elio sulla terra deriva dalla fissione nucleare di elementi radioattivi come l’uranio. Qui un nucleo radioattivo emette un nucleo di elio (noto anche come particella alfa). Immagine: Inductiveload

Spettro dell’elio con linea gialla prominente. Immagine: Nasa

William Ramsay che indica la colonna finale della tavola periodica contenente i gas nobili (o inerti). Ramsay ricevette il premio Nobel per la chimica nel 1904 per il suo lavoro nella scoperta dei gas inerti. Immagine: Vanity Fair
Scoperta dell’elio
La storia della scoperta dell’elio si intreccia con quella della scoperta della natura delle stelle.
Un tempo si credeva che non avremmo mai saputo di cosa sono fatte le stelle. Nel 1835 il filosofo francese Auguste Comte dichiarò: “Non saremo mai in grado con nessun mezzo di studiare la loro composizione chimica”. (1)
Comte pensava che avremmo potuto conoscere la materia stellare solo se fossimo riusciti a portarla in laboratorio.
Nonostante il pessimismo di Comte, il metodo per la scoperta dell’elio e delle composizioni delle stelle era già stato trovato. Nel 1814 il fisico tedesco Joseph Fraunhofer aveva preso il metodo di Isaac Newton di dividere la luce del sole usando un prisma e aveva fatto un progresso cruciale. Fraunhofer aveva notato delle linee scure nell’arcobaleno di colori provenienti dalla luce solare divisa da un prisma; le linee che vide furono la prima osservazione in assoluto dello spettro di una stella. (2), (3)
Nel 1859/60 gli scienziati tedeschi Gustav Kirchhoff e Robert Bunsen fecero enormi passi avanti nella scienza della spettroscopia, compresa la scoperta che le linee scure che Fraunhofer aveva visto erano come l’impronta digitale di una sostanza.
Lo scenario era pronto per Kirchhoff e Bunsen per scoprire nuovi elementi studiando la luce delle sostanze quando bruciavano.
Nel 1860 scoprirono il cesio dalle sue linee spettrali blu e nel 1861 il rubidio da due linee spettrali rosse. Poi William Crookes scoprì il tallio nel 1861 dopo aver osservato una linea spettrale verde brillante.
Kirchhoff e Bunsen guardarono lo spettro del sole e furono in grado di concludere che il ferro era presente nella sua atmosfera incandescente. (4)
Per la scoperta dell’elio fu necessario qualche anno in più. Nell’agosto del 1868 era prevista la prima eclissi totale da quando il lavoro di Kirchhoff e Bunsen era stato pubblicato.
L’astronomo francese Pierre Janssen stava aspettando un’eclissi per poter osservare le prominenze nella corona del sole usando uno spettroscopio. Nelle due settimane successive all’eclissi Janssen sviluppò un metodo per registrare gli spettri delle prominenze senza bisogno di un’eclissi. In questi spettri, egli osservò una linea gialla. (5)
La linea era in una posizione simile ma non identica alle linee nello spettro del sodio. Queste furono chiamate linee D1 e D2. Lo scienziato inglese Norman Lockyer studiò la nuova linea gialla; più tardi sarebbe stata chiamata linea D3. Pubblicò il suo studio della linea, consapevole che poteva essere causata da un nuovo elemento:
“…allora sapevamo che non avevamo a che fare con l’idrogeno; quindi avevamo a che fare con un elemento che non potevamo ottenere nei nostri laboratori, e quindi mi sono preso la responsabilità di coniare la parola elio, in prima istanza per uso di laboratorio.” (6)
Il nome elio veniva dalla parola greca per il sole, helios.
Lockyer e Edward Frankland, suo collega, avevano una serie di altre idee sulle possibili cause della linea gialla e quindi non annunciarono un nuovo elemento.
Nel 1871, altri scienziati erano consapevoli della situazione. Lord Kelvin discusse la “riflessione della luce dell’idrogeno incandescente e dell’elio intorno al sole”. L’uso di ‘elio’ è seguito da una nota per spiegarlo:
“Frankland e Lockyer trovano le prominenze gialle per dare una linea luminosa molto decisa non lontano da D, ma finora non identificata con alcuna fiamma terrestre. Sembra indicare una nuova sostanza, che essi propongono di chiamare Elio”. (7)
L’esistenza di Elio non fu però accettata da tutti. (5)
Tutti i dubbi furono dissipati quando il chimico scozzese William Ramsay isolò l’elio nel 1895 a Londra. Ramsay aveva scoperto l’argon nel 1894; l’argon fu il primo dei gas nobili ad essere scoperto. Nel 1895 lesse un articolo di William Hillebrand che descriveva un gas non reattivo che veniva rilasciato quando l’acido veniva aggiunto al minerale di uranio, l’uranite. Hillebrand credeva che il gas fosse azoto.
Ramsay, che credeva che il gas potesse contenere argon, ripeté l’esperimento di Hillebrand usando un altro minerale di uranio, la cleveite, e raccolse il gas.
Il suo spettroscopio indicava la presenza di azoto, argon e un altro gas. Ramsay sospettò che potesse essere elio, perché sembrava esserci una linea D3. (8) Sapendo che Lockyer e William Crookes avevano uno spettroscopio migliore del suo, mandò loro un campione del gas. Purtroppo il campione non era adatto, così Lockyer ottenne un campione di uranite, estrasse il gas e lo studiò allo spettroscopio. Egli scrive: (8)
“Una ad una le linee sconosciute che avevo osservato nel sole nel 1868 furono trovate appartenere al gas.”
Lo spettro del gas era identico all'”elio” del sole. Un nuovo elemento conquistò il suo posto nella tavola periodica.
Visita la Cool Helium Facts Page di Chemicool.

Aspetto e caratteristiche
Effetti nocivi:
L’elio non è noto per essere tossico.
Caratteristiche:
L’elio è un gas leggero, inodore, incolore, inerte, monoatomico. Può formare molecole biatomiche, ma solo debolmente e a temperature vicine allo zero assoluto.
L’elio ha il punto di fusione più basso di qualsiasi elemento e il suo punto di ebollizione è vicino allo zero assoluto.
A differenza di qualsiasi altro elemento, l’elio non si solidifica ma rimane un liquido fino allo zero assoluto (0 K) sotto pressioni ordinarie.
La voce di qualcuno che ha inalato elio suona temporaneamente acuta.
Usi dell’elio
La risonanza magnetica (MRI) è il più grande utente di elio. L’elio è usato per raffreddare i magneti superconduttori degli scanner MRI.
L’elio è usato per riempire i palloni (dirigibili) e per pressurizzare i razzi a combustibile liquido.
Miscele di elio e ossigeno sono usate come “aria” artificiale per i sub e altri che lavorano sotto pressione. L’elio è usato al posto dell’azoto nell’aria normale perché, dopo una lunga immersione, l’elio lascia il corpo più velocemente dell’azoto, permettendo una decompressione più veloce.
L’elio è usato come uno schermo di gas in prossimità della saldatura ad arco per prevenire, per esempio, qualsiasi reazione delle saldature di metallo caldo con l’ossigeno. Il gas è usato nell’industria dei semiconduttori per fornire un’atmosfera inerte per la crescita dei cristalli di silicio e germanio. Viene anche usato come gas ad alta temperatura nella produzione di titanio e zirconio, e come gas vettore nella gascromatografia.
Abbondanza e Isotopi
Abbondanza crosta terrestre: 8 parti per miliardo in peso, 43 parti per miliardo in mole
Abbondanza sistema solare: 23% in peso, 7.4% in mole
Costo, puro: $5.2 per 100g
Costo, sfuso: $ per 100g
Fonte: Quasi tutto l’elio sulla terra è il risultato del decadimento radioattivo. Le maggiori fonti di elio sono dai depositi di gas naturale nei pozzi in Texas, Oklahoma e Kansas. L’elio è estratto per distillazione frazionata del gas naturale, che contiene fino al 7% di elio.
Isotopi: L’elio ha 8 isotopi la cui emivita è nota, con numeri di massa da 3 a 10. L’elio presente in natura è una miscela dei suoi due isotopi stabili, 3He e 4He con abbondanze naturali di 0,0001% e 99,999% rispettivamente.

- Auguste Comte, Cours de Philosophie Positive at Project Gutenberg
- Keith J. Laidler, Il mondo della chimica fisica, 1993, p179.
- L’era della spettroscopia classica, da MIT Spectroscopy.
- Gerard G. Emch, Mathematical and Conceptual Foundations of 20th-Century Physics, 1984, Elsevier Science Publishers, p211
- Helge Kragh, The Solar Element: A Reconsideration of Helium’s Early History., 2009, Annals of Science, 66:2, p157-182.
- J. Norman Lockyer, The Growth of our Knowledge of Helium., Science Progress, 1896, Vol 5., p249
- W. Thomson, Discorso presidenziale, Associazione britannica per il progresso della scienza, 1871, (Indirizzo. XCIX).
- Sir Norman Lockyer, Il posto del sole in natura., 1897, p47-48
Citare questa pagina
Per il collegamento online, si prega di copiare e incollare uno dei seguenti:
<a href="https://www.chemicool.com/elements/helium.html">Helium</a>
o
<a href="https://www.chemicool.com/elements/helium.html">Helium Element Facts</a>
Per citare questa pagina in un documento accademico, utilizzare la seguente citazione conforme a MLA:
"Helium." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/helium.html>.