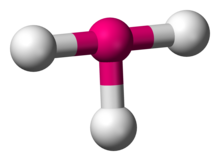
In chimica, la geometria molecolare a forma di T descrive le strutture di alcune molecole in cui un atomo centrale ha tre ligandi. Ordinariamente, i composti a tre coordinate adottano geometrie trigonali planari o piramidali. Esempi di molecole a forma di T sono i trifluoruri di alogeni, come ClF3.
ClF3
C2v
90°, 180°
>0

Secondo la teoria VSEPR, la geometria a T risulta quando tre ligandi e due coppie solitarie di elettroni sono legati all’atomo centrale, scritto in notazione AXE come AX3E2. La geometria a forma di T è legata alla geometria molecolare bipiramidale trigonale per le molecole AX5 con tre ligandi equatoriali e due assiali. In una molecola AX3E2, le due coppie solitarie occupano due posizioni equatoriali, e i tre atomi del ligando occupano le due posizioni assiali e una posizione equatoriale. I tre atomi si legano ad angoli di 90° su un lato dell’atomo centrale, producendo la forma a T.
L’anione trifluoroxenato(II), XeF-
3, è stato studiato come un possibile primo esempio di molecola AX3E3, che potrebbe essere previsto dal ragionamento VSEPR per avere sei coppie di elettroni in una disposizione ottaedrica con entrambe le tre coppie solitarie e i tre ligandi in un orientamento mer o T. Sebbene questo anione sia stato rilevato in fase gassosa, i tentativi di sintesi in soluzione e la determinazione sperimentale della struttura non hanno avuto successo. Uno studio di chimica computazionale ha mostrato una geometria planare distorta a forma di Y con il più piccolo angolo di legame F-Xe-F pari a 69°, piuttosto che 90° come in una geometria a forma di T.
.