Abstract
Le infezioni del tratto urinario (UTI) sono un problema globale. La maggior parte della ricerca sulle UTI si concentra sull’eziologia dei gram-negativi. Le Enterobacteriaceae sono risultate essere l’infezione UTI più prevalente, costituendo più dell’80% di tutti i casi riportati. I principali batteri gram-positivi nei casi di UTI sono Staphylococcus saprophyticus, Enterococcus faecalis, Streptococcus agalactiae. I patogeni gram-positivi sono stati riportati in diversi paesi sia nelle UTI non complicate che in quelle complicate. La terapia antibiotica dei batteri gram-positivi è completamente diversa da quella dei patogeni gram-negativi delle UTI. Tuttavia, i sintomi associati alle UTI causate da gram-positivi e gram-negativi sono molto simili. Senza una diagnosi corretta, c’è un’alta possibilità di ottenere una diagnosi sbagliata e una conseguente terapia antibiotica. Sono disponibili studi molto limitati che mettono a fuoco l’eziologia e le loro suscettibilità antibiotiche nella prospettiva del Bangladesh. Abbiamo mirato a cercare in questa area di ricerca di riempimento delle lacune. Questo studio ha rilevato l’8,2% di batteri gram-positivi nei pazienti UTI. La prevalenza mostra l’armonia con i rapporti pubblicati in precedenza. Maschi e femmine sono stati trovati infettati allo stesso modo da patogeni UTI gram-positivi. La maggior parte delle pubblicazioni precedenti mostra che la femmina è più vulnerabile ai batteri UTI gram-negativi. Improbabile, i nostri risultati guardano i maschi sono ugualmente vulnerabili ai gram-positivi rispetto alle femmine. Ulteriori studi con più dimensioni del campione possono garantire i risultati preliminari. Le analisi dell’antibiogramma hanno mostrato l’amikacina e la gentamicina come gli antibiotici più efficaci contro i nostri isolati testati. Al contrario, la nitrofurantoina è stata trovata il farmaco più inefficace in questo studio. I risultati dello studio potrebbero aiutare nella prescrizione di antibiotici da questo studio basato sull’evidenza.
Parole chiave
uropatogeno, UTI, resistenza antimicrobica, trattamento empirico, Bangladesh
Abbreviazioni
API: Analytic Profile Index; CLSI: Clinical and Laboratory Standards Institute; CLED: Cysteine Lactose Electrolyte Deficient Agar; MDR: Multi Drug Resistant; MHA: Muller Hinton Agar; PBS: UTI: Infezione del tratto urinario
Introduzione
L’infezione del tratto urinario (UTI) è una delle malattie infettive più comuni. I principali agenti causali delle UTI sono Escherichia coli e altre Enterobacteriaceae. Le restanti proporzioni sono associate a una varietà di organismi, compresi i batteri Gram-positivi Staphylococcus saprophyticus, Enterococcus faecalis, Streptococcus agalactiae (Streptococco di gruppo B, GBS), e altri organismi isolati meno frequentemente. I batteri uropatogeni gram-positivi più prevalenti includono Staphylococcus saprophyticus e Enterococcus facecalis. Gli uropatogeni gram-positivi sono stati riportati in diversi paesi sia in UTI non complicate che complicate. Non ci sono tali studi esclusivi sono stati fatti nella popolazione del Bangladesh per cercare l’eziologia dell’UTI gram-positiva. Senza una diagnosi corretta, c’è un’alta possibilità di ottenere farmaci sbagliati e inappropriati e conseguenti effetti collaterali avversi del trattamento associato. I batteri gram-positivi si trovano più spesso come agenti eziologici dell’UTI tra le donne incinte e gli anziani. Inoltre, le UTI complicate si verificano spesso in ambienti nosocomiali e/o istituzionali e questi individui sono a maggior rischio di UTI gram-positive e polimicrobiche. Rappresenta una grande proporzione del consumo di antibiotici, ha un grande impatto socioeconomico e può contribuire alla resistenza batterica. I medici devono spesso affrontare problemi nella scelta dell’antibiotico appropriato per la terapia empirica per il trattamento delle UTI. In Bangladesh, l’uso indiscriminato di antibiotici porta molti esiti negativi per i pazienti UTI clinicamente con un carico economico esteso. Questo studio mirava a valutare il profilo di suscettibilità degli uropatogeni gram-positivi contro diversi antibiotici prescritti. Il nostro studio ha razionalizzato la necessità di un monitoraggio continuo dei pazienti con infezione del tratto urinario per una migliore comprensione della loro epidemiologia attuale di ceppi batterici gram-positivi nella popolazione del Bangladesh.
Metodi e materiali
Raccolta dei dati
Le informazioni socio-demografiche dei pazienti, la storia del trattamento (se i pazienti sono stati trattati con una terapia antimicrobica), e qualsiasi informazione clinica rilevante (calcoli renali, gravidanza, uso recente del catetere) sono stati registrati da un questionario strutturato.
Disegno dello studio e raccolta dei campioni
Uno studio trasversale è stato condotto tra luglio 2018 e dicembre 2018 per cercare isolati batterici gram-positivi da pazienti con infezione del tratto urinario. Questo studio è stato progettato sulla base di indagini di laboratorio di campioni di urina raccolti da pazienti UTI che frequentano in diversi ospedali di comunità nella zona di Savar. Per attuare la pianificazione, è stato chiesto ai probabili pazienti con infezione delle vie urinarie che si sono rivolti al medico presso il Gonosastha Hospital e l’Enam Medical College di Savar, Dhaka, di partecipare a questo studio. Lo studio include pazienti consenzienti che hanno prove cliniche di UTI con sintomi da meno di sette giorni e che si presentano al reparto ambulatoriale degli ospedali e quelli ricoverati per meno di 48 ore.
Isolamento e identificazione batterica
Per isolare l’agente patogeno dell’UTI, sono stati raccolti campioni di urina a flusso medio puliti in provette di vetro sterili e inoculati su un terreno di coltura differenziale, cisteina, lattosio ed elettroliti deficitari (CLED) agar (Lyophilchem, Italia). Ai pazienti è stata spiegata in anticipo la procedura standard di campionamento midstream clean-catch per evitare la contaminazione con batteri commensali. Per evitare risultati falsi positivi, i campioni di urina sono stati piastrati entro 2 ore dalla raccolta. L’utilizzo dell’agar CLED offre il vantaggio di supportare la crescita della maggior parte dei potenziali uropatogeni, compresi i cocchi gram-positivi come Staphylococcus aureus, Staphylococcus saprophyticus ed Enterococcus spp. In parallelo, è stato inoculato il Mannitol Salt Agar (MSA) per la crescita dei gram-positivi UTI. Le colture di urina sono state incubate durante la notte a 35ºC-37ºC in aria ambiente. Sono state eseguite colture quantitative delle urine e la conta delle colonie di 102 o 103 UFC/mL è stata considerata per definire una probabile infezione dell’UTI nei rispettivi pazienti. Conteggi di colonie inferiori a 102 CFU/mL sono stati considerati come potenziale contaminazione. Le colonie batteriche purificate sono state identificate mediante colorazione di Gram, procedure biochimiche convenzionali seguite da un kit di test biochimici rapidi (API 20E, BioMe´rieux, Durham, NC) costituito da una serie di pannelli cromogenici, batterie di carboidrati e substrati enzimatici. L’identificazione batterica è stata ulteriormente convalidata dalla genotipizzazione utilizzando 16S rRNA degli isolati in parte.
Valutazione della sensibilità antimicrobica
Gli isolati sono stati sottoposti a test di sensibilità antibiotica in vitro con il metodo standard di diffusione del disco di Kirby-Bauer e le zone di inibizione sono state interpretate seguendo le raccomandazioni CLSI (Clinical amp; Laboratory Standards Institute-2010). Sei dischi di antibiotici da beta-lattamici, nitrofurantoina e fluorochinolone sono stati posti sul prato batterico e incubati a 37ºC per determinare il modello di sensibilità. I batteri sensibili hanno dato una zona chiara intorno al disco antibiotico e il diametro della zona è stato misurato per confrontarlo con lo standard.
Rilevamento dei geni resistenti alla β-lattamasi e al chinolone
Isolati che mostravano fenotipi di resistenza sono stati sottoposti a PCR per il rilevamento del gene blaTEM e qnrS. Sono stati preparati un totale di sei lisati batterici. La PCR è stata effettuata in una provetta PCR contenente lisato batterico come modello di DNA (1 µl) con un volume finale di 12 µl contenente DNA 2x premix (6 µl), 5 pmol di ciascun primer (1 µl) e acqua deionizzata (4 µl). La PCR è stata eseguita in un termociclatore e le condizioni di ciclo per bla TEM e qnrS sono state: denaturazione iniziale a 94°C per 5 min seguita da 32 cicli di amplificazione con denaturazione a 94°C per 30 s, annealing a 50°C per 30 s (blaTEM) e 55°C per 30 s (qnrS) ed estensione a 72°C per 1 min, terminando con un’estensione finale a 72°C per 7 min. I prodotti di PCR della dimensione prevista sono stati purificati e sequenziati usando gli stessi primer usati per generare i prodotti di PCR.
Analisi statistiche
Come descritto, la versione convalidata in Bangla del questionario è stata usata per la raccolta dati. I moduli di raccolta dati compilati sono stati ricontrollati dai supervisori della raccolta dati. Le analisi di laboratorio del 10% selezionate a caso sono state effettuate due volte da un ricercatore diverso per garantire l’autenticità dei dati di laboratorio e per valutare le distorsioni tra ricercatori. I dati verificati sono stati inseriti e successivamente analizzati utilizzando l’editor di dati statistici IBM SPSS (versione 21). I dati mancanti sono stati esclusi dall’analisi bivariata. Le statistiche descrittive sono state riportate come frequenza, percentuale e media, quando applicabile, insieme alla deviazione standard. La suscettibilità antimicrobica dei batteri del test è stata valutata con una scala di valutazione categorica di 3 tipi: suscettibile (antibiotico indicato come completamente efficace), intermedio (indicato come parzialmente efficace) e resistente (indicato come non efficace). Per testare l’associazione tra dati categorici, è stato utilizzato il test chi-quadro di Pearson, e la correzione di Yate per la continuità è stata applicata dove appropriato. Come tale è stata calcolata l’esposizione degli antimicrobici all’acquisizione del gene resistente agli antibiotici. Il coefficiente di correlazione è stato calcolato per verificare la forza dell’associazione. Sono stati eseguiti test t a campione indipendente per confrontare le medie delle variabili continue. Un p-value a due code inferiore a 0,05 è stato considerato statisticamente significativo.
Risultati
Demografia della popolazione in studio
Abbiamo avvicinato i pazienti che hanno frequentato i medici del Gonosatha Medical College con le loro complicazioni associate all’UTI. Abbiamo incluso in questo studio 147 pazienti che avevano sintomi clinici gravi. Di questi, 36 (24,5%) erano maschi e i restanti 111 (75,5%) erano femmine. Pertanto, quasi tre volte i pazienti UTI sono stati trovati di sesso femminile rispetto al loro genere opposto (Figura 1). Il test del Chi-quadro ha mostrato che il sesso femminile è associato a un numero significativamente più alto di eventi UTI (p = 0,04). La distribuzione dell’età dei casi del nostro studio va da meno di un anno a più di 70 anni. Tuttavia, l’infezione UTI più frequente era nel gruppo di età tra 21-30 anni. La distribuzione complessiva dei casi in base all’età è stata descritta nella tabella 1. Un totale di cinque su 12 Staphylococcus spp (42%) è stato identificato nel gruppo di età 21-30 anni. Nessun’altra tendenza è stata osservata nella distribuzione per età dell’infezione UTI gram-positiva.
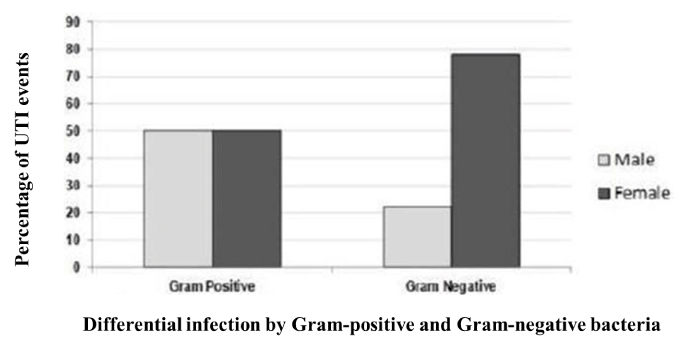
Figura 1. Distribuzione dei batteri gram-positivi e gram-negativi tra maschi e femmine. Le donne avevano un numero significativamente più alto di UTI rispetto ai maschi che erano causati da batteri gram-negativi. Nel caso dell’infezione gram-positiva del tratto urinario, maschi e femmine hanno mostrato la stessa vulnerabilità
Tabella 1. Età -distribuzione dei pazienti dello studio UTI
|
Età in anni |
Numero di pazienti UTI |
Frequenza % |
|
Totale |
Isolamento e identificazione di patogeni gram-positivi dell’UTI
Abbiamo esaminato 147 campioni di urina di pazienti clinicamente sintomatici. Il terreno di coltura CLED ha prodotto colonie di colore diverso per diversi patogeni UTI. Lo Staphylococcus aureus Gram-positivo produce colonie gialle e lo Staphylococcus saprophyticus genera colonie da bianche a giallastre, mentre Enterococcus spp produce colonie da incolori a gialle. I batteri Gram-negativi producono altri colori diversi. Pertanto, identificare i batteri UTI osservando i colori delle colonie sul CLED può essere presuntivo, ma difficile da concludere. Abbiamo sub-colto le probabili colonie Gram-positive dal terreno di coltura CLED su Mannitol Salt Agar (MSA) e incubato per una notte a 37°C. Le colonie di crescita su MSA hanno mostrato un colore bianco-giallastro e rosa. I batteri del MSA sono stati sottoposti alla colorazione di Gram e sono risultati di natura Gram-positiva. I batteri UTI gram-positivi preliminari sono stati identificati da questo studio come specie di Staphylococcus. L’analisi Analytical profiling index (API) e/o il sequenziamento del DNA 16sRNA possono essere fatti per identificare l’eziologia a livello di specie. Abbiamo rilevato 12 patogeni UTI gram-positivi, che erano l’8,2% della popolazione totale dei patogeni.
Modello di resistenza antimicrobica degli isolati UTI gram-positivi
L’esperimento di diffusione a disco ha prodotto zone chiare di prato batterico su agar Muller-Hinton (MH), indicando la suscettibilità dei rispettivi antibiotici impregnati lì. Al contrario, gli isolati resistenti non hanno permesso una zona chiara anche in presenza del disco antibiotico. Una tendenza mista della suscettibilità contro gli antibiotici testati è stata osservata nella nostra valutazione. La resistenza più alta è stata trovata contro la nitrofurantoina (91,7%), seguita da amoxicillina (83%), ofloxacillina (50%). Sia la gentamicina che l’amikacina sono stati trovati farmaci molto efficaci, dove solo l’8,3% è stato trovato resistente (Figura 2).
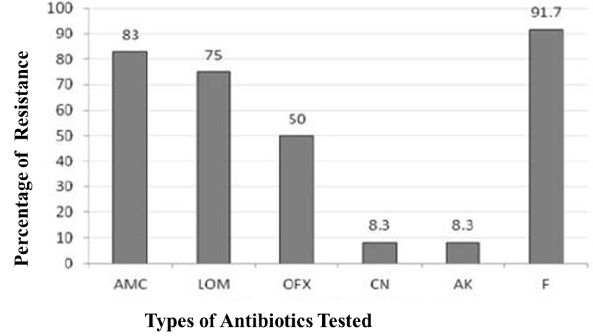
Figura 2. Prevalenza di resistenza agli antibiotici tra i batteri UTI gram-positivi.
AMC: Amoxicillina; LOM: Lomefloxacina; OFX: Ofloxacina; CN: Gentamicina; AK: Amikacina; F: Nitrofurantoina. L’amikacina e la gentamicina sono apparsi gli antibiotici più efficaci contro i batteri UTI Gram-positivi. La Nitrofurantoina è stata trovata la meno efficace tra gli antibiotici testati.
Geni resistenti agli antibiotici negli uropatogeni gram-positivi
Abbiamo preparato campioni di DNA da tutti i 12 isolati gram-positivi con il metodo della bollitura a caldo. Le pareti cellulari dei batteri gram-positivi sono di solito molto più rigide dei batteri gram-negativi, il che può influenzare la liberazione del DNA nei metodi di ebollizione a caldo. Nell’analisi attuale, abbiamo esaminato l’anello beta-lattamico contenente il gene bla-TEM resistente agli antibiotici e abbiamo trovato due isolati (2/6, 33%) positivi. Allo stesso modo, abbiamo controllato il gene qnr-S resistente agli antibiotici del gruppo fluorochinolone e abbiamo trovato tre isolati positivi (3/6, 50%).
Discussione
Le infezioni del tratto urinario rappresentano una delle malattie più comuni incontrate nella pratica medica, causando una significativa morbilità associata e verificandosi dai neonati agli anziani. La prevalenza delle infezioni può variare con l’età, il sesso e alcuni fattori predisponenti. La maggior parte dell’infezione UTI riportata è stata causata da batteri gram-negativi, principalmente Enterobacteriaceae. C’erano anche forti evidenze contro l’infezione UTI gram-positiva. Abbiamo cercato di esaminare la prevalenza di patogeni UTI gram-positivi nella popolazione del Bangladesh. I trattamenti empirici per l’infezione urinaria basata su criteri di gravità e sintomi clinici portano una grande sfida. Poiché la terapia antibiotica dei batteri gram-positivi è completamente diversa da quella dei patogeni UTI gram-negativi, c’è un’alta possibilità di ottenere il trattamento sbagliato con un approccio empirico. Pertanto, una diagnosi corretta con un test di suscettibilità antibiotica specifico è imperativo per impostare qualsiasi trattamento di stewardship. Poiché l’UTI è una comune malattia acquisita dalla comunità in Bangladesh, una percentuale significativa della popolazione viene infettata da questa malattia ogni anno. Lo studio è stato progettato per controllare le suscettibilità antimicrobiche dei patogeni gram-positivi dell’UTI. Abbiamo rilevato circa l’8,2% di eziologie UTI gram-positive, in particolare, Staphylococcus aureus, Staphylococcus saprophyticus, e Enterococcus spp. che hanno allegato precedenti rapporti pubblicati .
Comunemente, l’infezione UTI è stata registrata molto più alta nelle femmine che nei maschi . Improbabile, abbiamo trovato la metà dell’infezione gram-positiva è stata riportata nei maschi. I risultati preliminari hanno mostrato che i maschi sono più vulnerabili ai gram-positivi rispetto alla situazione generale. La distribuzione dell’età dei casi del nostro studio va da meno di un anno a più di 70 anni. Tuttavia, l’infezione UTI gram-positiva più frequente era nel gruppo di età tra 21-30 anni come sostenuto altrove.
La resistenza antibiotica tra gli uropatogeni è diventata una preoccupazione per la salute pubblica in Bangladesh. In questo studio, i profili di suscettibilità antibiotica dei patogeni UTI gram-positivi sono stati determinati con sei diversi dischi antibiotici mediante test di diffusione del disco. La più alta percentuale di resistenza è stata osservata contro la nitrofurantoina, mentre la più bassa percentuale di resistenza è stata trovata contro l’amikacina e la gentamicina. Meno del 10% degli uropatogeni gram-positivi sono apparsi resistenti contro questi due antibiotici del gruppo degli aminoglicosidi. I risultati supportano l’aminoglicoside come farmaco di scelta per i patogeni gram-positivi delle UTI. Tra gli antibiotici del gruppo dei chinoloni, la più alta percentuale di resistenza è stata trovata dalla lomefloxacina di seconda generazione (75%). I nostri risultati dell’antibiogramma hanno mostrato che la nitrofurantoina non era un farmaco molto efficace per i batteri UTI gram-positivi. Il vecchio antibiotico beta-lattamico, amoxicillina era debolmente funzionale contro i patogeni gram-positivi UTI. Gli antibiotici fluorochinolonici, ofloxacillina e lomefloxacina sono risultati moderatamente efficaci.
Gli isolati sono stati testati per i geni AMR selezionati mediante reazione a catena della polimerasi (PCR), utilizzando primer specifici per il rilevamento di bla-TEM e qnrS. Circa il 33% degli isolati era positivo per bla-TEM e il 50% era positivo per qnrS. I geni resistenti agli antibiotici sono stati rilevati e hanno mostrato armonia con il modello di suscettibilità fenotipica. Anche se con la massima sincerità e dedizione sono stati indagati per effettuare lo studio non poteva andare oltre i limiti come la dimensione del campione non era abbastanza grande. Nonostante questa limitazione, si spera che questa scoperta dello studio aiuterà i medici che decidono di prescrivere antibiotici dallo studio basato sull’evidenza. Il clinico dovrebbe occuparsi della diagnosi specifica prima di prescrivere una terapia antibiotica empirica, in particolare per l’UTI maschile.
Dichiarazione etica
Questo studio è stato approvato dal Comitato etico e di revisione della ricerca della Jahangirnagar University, Facoltà di Scienze Biologiche e il consenso verbale è stato ottenuto dai pazienti UTI e dai medici.
Riconoscimenti
Gli autori vogliono ringraziare i rispettivi pazienti e medici per la loro collaborazione. Gli autori riconoscono il contributo del personale del laboratorio generale, Dipartimento di Microbiologia, Jahangirnagar University.
Discrezione
Questo lavoro è stato parzialmente supportato dal Grant for Advance Research (GARE), Ministero dell’Educazione e dal Ministry of Science and Technology Research Grant, Bangladesh, al Dr. Md. Salequl Islam.
- Stamm WE, Norrby SR (2001) infezioni del tratto urinario: panorama delle malattie e sfide. J Infect Dis 183: S1-S4.
- Hooton TM (2012) Pratica clinica. Infezione non complicata del tratto urinario. J Infect Dis 366: 1028-1037. Epub 2012/03/16.
- Piette A, Verschraegen G (2009) Ruolo degli stafilococchi coagulasi-negativi nella malattia umana. Vet Microbiol 134: 45-54.
- Edwards MS, Baker C (2005) Infezioni da streptococco di gruppo B. GRUPPO 12:c0060.
- Matthews SJ, Lancaster JW (2011) Infezioni del tratto urinario nella popolazione anziana. Am J Geriatr Pharmacother 9: 286-309.
- Kline KA, Lewis AL (2016) uropatogeni Gram-positivi, infezioni polimicrobiche del tratto urinario e il microbiota emergente del tratto urinario. Microbiol Spectr 4: 2.
- Clouse K, Shehabi A, Suleimat AM, Faouri S, Khuri-Bulos N, et al. (2019) Alta prevalenza di colonizzazione di Streptococco di gruppo B tra le donne in gravidanza ad Amman, in Giordania. BMC pregnancy and childbirth 19: 177.
- de Sousa VS, da-Silva APS, Sorenson L, Paschoal RP, Rabello RF, et al. (2017) Staphylococcus saprophyticus recuperato da esseri umani, cibo e acque ricreative a Rio de Janeiro, Brasile. Int J Microbiol 2017: 4287547
- Lee DH, Klinkova O, Kim JW, Nanjappa S, Greene JN (2019) A Case Series of Staphylococcus lugdunensis Infection in Cancer Patients at an Academic Cancer Institute in the United States. Infect Chemo 51: 45-53.
- Kunin CM (1994) Infezioni del tratto urinario nelle femmine. Clin Infect Dis 18: 1-10.
- Croxen MA, Finlay BB (2010) meccanismi molecolari di patogenicità di Escherichia coli. Nat Rev Microbiol 8: 26-38.
- Grude N, Tveten Y, Kristiansen BE (2001) Infezioni del tratto urinario in Norvegia: eziologia batterica e suscettibilità. Uno studio retrospettivo di isolati clinici. Clin Microbiol Infect 7: 543-547.
- Falagas ME, Giannopoulou KP, Kokolakis GN, Rafailidis PI (2008) Fosfomicina: uso oltre le infezioni del tratto urinario e gastrointestinale. Clin Infect Dis 46: 1069-1077.
- Stamm WE, Counts GW, Running KR, Fihn S, Turck M, et al. (1982) Diagnosi di infezione da coliformi in donne acutamente disuriche. N Engl J Med 307: 463-468.
- Detweiler K, Mayers D, Fletcher SG (2015) Batteruria e infezioni del tratto urinario negli anziani. Urol Clin North Am 42: 561-568.
- Arshad M, Seed PC (2015) Infezioni del tratto urinario nel neonato. Clin Perinatol 42: 17-28.
- Tien BYQ, Goh HMS, Chong KKL, Bhaduri-Tagore S, Holec S, et al. (2017) Enterococcus faecalis promuove la soppressione immunitaria innata e l’infezione polimicrobica del tratto urinario associata al catetere. Infect Immun pii: e00378-17.
- Vasquez V, Ampuero D, Padilla B (2017) Infezioni del tratto urinario in pazienti ricoverati: che sfida. Rev Esp Quimioter 30: S39-S41.
- Hooton TM, Stamm WE (1997) Diagnosi e trattamento dell’infezione non complicata del tratto urinario. Infect Dis Clin North Am 11: 551-581.
- Medina M, Castillo-Pino E (2019) Un’introduzione all’epidemiologia e al peso delle infezioni del tratto urinario. Ther Adv Urol 11: 1756287219832172.
- Wallmark G, Arremark I, Telander B (1978) Staphylococcus saprophyticus: una causa frequente di infezione acuta del tratto urinario tra i pazienti ambulatoriali femminili. J Infect Dis 138: 791-797.