I termini luminescenza, fotoluminescenza, fluorescenza e fosforescenza sono abitualmente usati nei documenti di ricerca per descrivere l’emissione di luce da un campione. Questa denominazione multipla può confondere con molti dei termini usati in modo intercambiabile e con ricercatori di diversa formazione scientifica che preferiscono usare un nome piuttosto che un altro. In questo articolo rispondiamo alla domanda “Qual è la differenza tra luminescenza, fotoluminescenza, fluorescenza e fosforescenza”.
Che cos’è la luminescenza?
La luminescenza è qualsiasi emissione di luce (onde elettromagnetiche) da una sostanza che non deriva dal riscaldamento. Questa definizione distingue la luminescenza dall’incandescenza, che è l’emissione di luce dovuta all’elevata temperatura di una sostanza, come un tizzone incandescente. La parola luminescenza deriva dalla parola latina per luce, lumen, e dal latino, escentia, che significa ‘il processo di’ e quindi è il processo di emissione di luce.

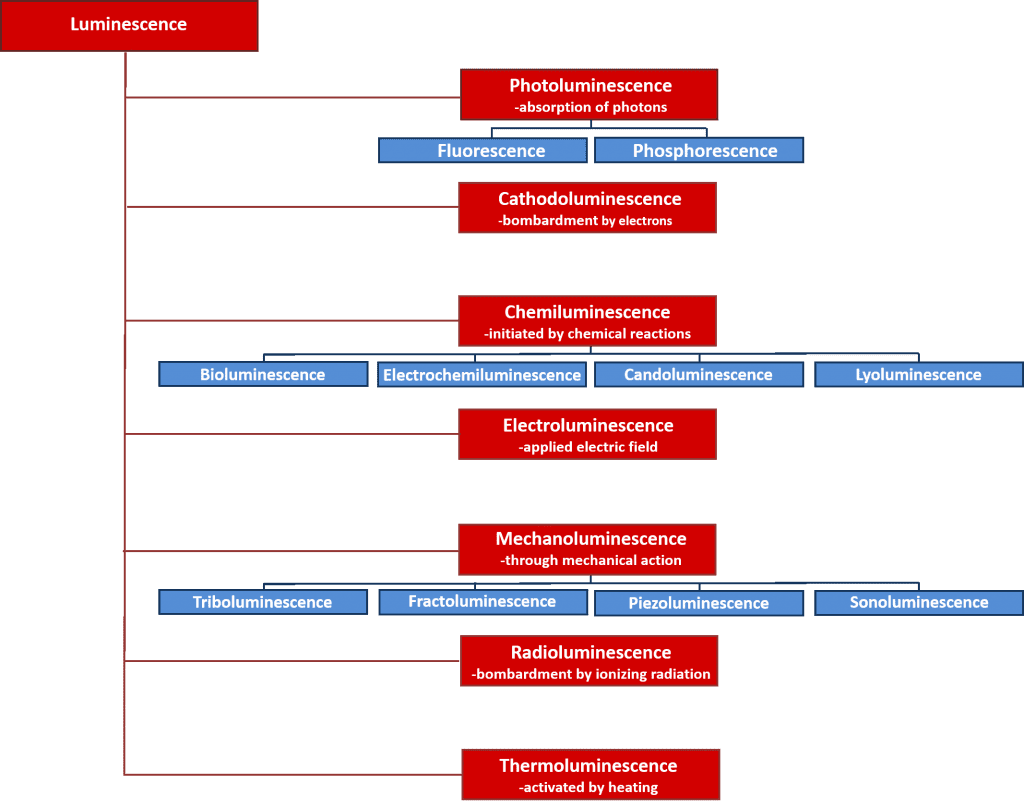
Ci sono molti tipi di luminescenza che possono essere classificati in base alla fonte di energia che avvia il processo di luminescenza. Una panoramica dei vari tipi di luminescenza e delle loro fonti di energia è data nella figura 2. Molti di questi processi di luminescenza hanno importanti applicazioni scientifiche e industriali come l’elettroluminescenza dove la luce è emessa sulla ricombinazione di elettroni e buchi dopo l’applicazione di un campo elettrico attraverso un materiale, ed è il principio operativo dietro i diodi che emettono luce; e la chemiluminescenza dove l’emissione di luce è iniziata da una reazione chimica e usata nei saggi biologici ed è responsabile del bagliore dei bastoni luminosi. Tuttavia, il focus di questo articolo è sulla fotoluminescenza che costituisce la base della potente tecnica spettroscopica non distruttiva, la spettroscopia di fotoluminescenza, che è ampiamente utilizzata sia nel mondo accademico che nell’industria.
Che cos’è la fotoluminescenza?
La fotoluminescenza è l’emissione di luce da un materiale dopo l’assorbimento della luce. La parola in sé è interessante in quanto è la combinazione della parola di derivazione latina luminescenza e il prefisso greco, photo-, per luce. Qualsiasi luminescenza che è indotta dall’assorbimento di fotoni è chiamata fotoluminescenza. Questa potrebbe anche essere l’emissione di luce da una molecola di colorante organico in soluzione (Figura 3a), o la ricombinazione band-to-band di elettroni e buchi dopo la fotoeccitazione di un semiconduttore (Figura 3b).

Descrivere qualsiasi emissione di luce indotta dall’assorbimento di fotoni come fotoluminescenza è accurato; tuttavia, è pratica comune, in particolare per i chimici, suddividere ulteriormente la fotoluminescenza in fluorescenza e fosforescenza.
Qual è la differenza tra fluorescenza e fosforescenza?
Ci sono varie definizioni di fluorescenza e fosforescenza e la più semplice è che la fluorescenza è una fotoluminescenza immediata che si verifica poco dopo la fotoeccitazione di una sostanza, mentre la fosforescenza è una fotoluminescenza di lunga durata che continua molto tempo dopo la cessazione della fotoeccitazione. Anche se questa è una definizione semplice, non spiega perché si verifica una tale differenza nelle scale temporali della fotoluminescenza e alcuni materiali possono cadere in una zona grigia tra le classiche scale temporali della fluorescenza e della fosforescenza. Una definizione più approfondita deve essere basata sulla meccanica quantistica degli stati eccitati e di massa coinvolti nel processo di emissione. Usando questo approccio, la fluorescenza e la fosforescenza possono essere definite come fotoluminescenza dove la transizione radiativa non richiede un cambiamento nella molteplicità di spin e fotoluminescenza dove la transizione radiativa comporta un cambiamento nella molteplicità di spin, rispettivamente.
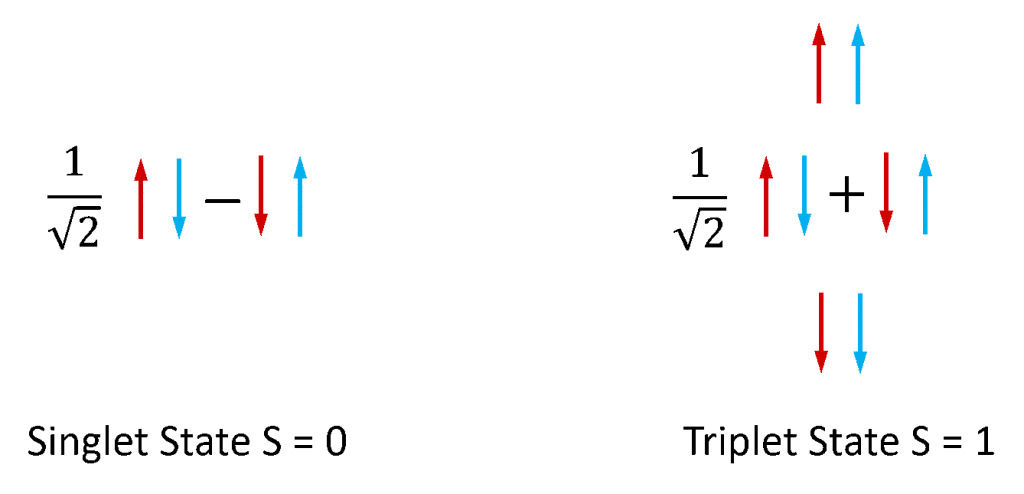
Fluorescenza e fosforescenza sono più comunemente usate per riferirsi alla fotoluminescenza da sistemi molecolari. Gli elettroni nelle molecole stabili esistono sempre in coppia, poiché le molecole con elettroni spaiati sono estremamente reattive e instabili. Gli elettroni possiedono un momento angolare intrinseco noto come ‘spin’ e una coppia di elettroni può esistere in uno dei due stati di spin totali a seconda della simmetria relativa degli spin dei due elettroni. Se i due spin sono in una configurazione antisimmetrica la coppia di elettroni ha uno spin totale di zero (S = 0) mentre se sono in una configurazione simmetrica allora la coppia ha uno spin totale di uno (S = 1). Come illustrato nella figura 4 c’è una combinazione di stati di coppia di spin degli elettroni che è antisimmetrica e tre combinazioni di stati di coppia di spin che sono simmetrici e gli stati S = 0 e S = 1 sono quindi chiamati rispettivamente singoletto e tripletto.
Quando un fotone viene assorbito dalla molecola, uno degli elettroni viene promosso ad un livello energetico superiore e la molecola è ora in uno stato eccitato. Lo stato fondamentale di una molecola è (quasi) sempre uno stato singoletto (S0) e a causa della conservazione del momento angolare lo stato fotoeccitato deve essere anch’esso un singoletto (S1) come mostrato nel diagramma di Jablonski qui sotto. Il decadimento dello stato S1 verso lo stato S0 è una transizione permessa (dato che entrambi gli stati hanno la stessa molteplicità di spin) con conseguente fotoluminescenza immediata che si verifica nella scala temporale da picosecondi a nanosecondi ed è chiamata fluorescenza.
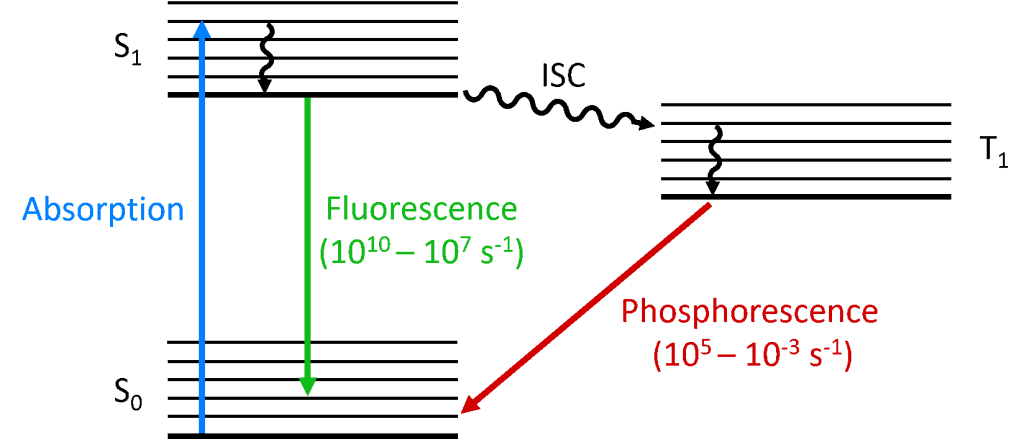
In alternativa, la molecola può subire il passaggio intersistemico (ISC) allo stato eccitato di tripletto (T1). ISC si verifica tipicamente in molecole con un alto grado di accoppiamento spin-orbita, l’accoppiamento del momento angolare orbitale e il momento angolare di spin dell’elettrone, che permette la conversione tra gli stati di singoletto e tripletto. La forza di accoppiamento spin-orbita aumenta con la massa dell’atomo, e le molecole fosforescenti devono quindi contenere metalli pesanti come l’Europio e l’Iridio. Il decadimento dello stato T1 di nuovo allo stato S0 è una transizione proibita poiché gli stati hanno una molteplicità di spin diversa, a causa della conservazione del momento angolare. Tuttavia, l’accoppiamento spin-orbita allenta questa restrizione e una transizione radiativa dal T1 al S1 diventa possibile. Poiché è “proibita”, la fotoluminescenza che risulta dalla transizione da T1 a S0 avviene su una scala temporale molto più lenta, da microsecondi a migliaia di secondi, ed è chiamata fosforescenza.
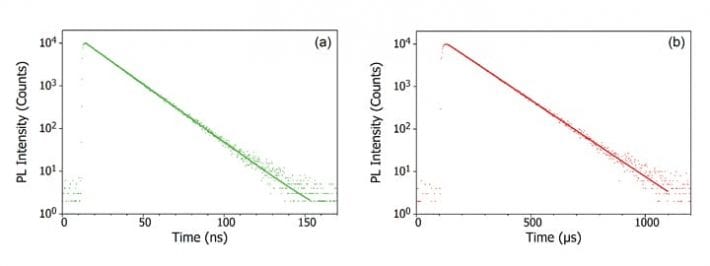
Si dovrebbe anche notare che l’emissione da alcuni materiali non sempre rientra ordinatamente in una categoria o nell’altra. Un esempio di questo è la fluorescenza ritardata attivata termicamente (TADF). Nella TADF i livelli S1 e T1 sono vicini in energia e fortemente accoppiati, e l’ISC inverso dal T1 al S1 è quindi possibile. Questo dà luogo a una transizione ritardata da S1 a S0 che risulta in una fotoluminescenza su una scala temporale tra la fluorescenza e la fosforescenza, nota come fluorescenza ritardata. Per maggiori informazioni sulla TADF e il suo utilizzo negli OLED ad alta efficienza, leggere il post su “Cos’è la TADF?”.
Quando descrivere l’emissione come fotoluminescenza rispetto a fluorescenza/fosforescenza è in definitiva una questione di preferenze personali. I chimici e i biologi, che studiano principalmente i sistemi molecolari, favoriscono l’uso della fluorescenza e della fosforescenza poiché in questi sistemi molecolari altamente localizzati ci sono stati distinti di singoletto e tripletto. Al contrario, i fisici studiano prevalentemente materiali semiconduttori dove gli elettroni sono altamente delocalizzati e il concetto di singoletto e tripletto cessa spesso di essere rilevante. Questo è uno dei motivi per cui i fisici tendono a usare il termine più ampio di fotoluminescenza per descrivere l’emissione di luce.
Comunque si decida di chiamarla, la fotoluminescenza, la fluorescenza e la fosforescenza possono fornire una ricchezza di informazioni sulle proprietà di molecole e materiali; dalla determinazione della vita dei portatori di carica nelle celle solari alla misurazione della dinamica di solvatazione intorno alle micelle nelle cellule viventi.
Prodotti per luminescenza, fotoluminescenza, fluorescenza e fosforescenza
Per misurare la fotoluminescenza è necessario uno spettrometro per fotoluminescenza ed Edinburgh Instruments offre una gamma di spettrometri per fotoluminescenza a conteggio di fotoni singoli per misurare gli spettri di fotoluminescenza, i tempi di vita, l’anisotropia e la resa quantica dei vostri campioni.
Tieniti in contatto
Se ti è piaciuto leggere questo articolo e vuoi essere il primo a vedere tutte le ultime notizie, applicazioni e informazioni sui prodotti di Edinburgh Instruments, allora iscriviti alla nostra newsletter infrequente tramite il pulsante rosso di iscrizione qui sotto, e seguici sui social media.