はじめに
膵臓癌は通常、膵臓原発悪性腫瘍の90%以上を占める膵管癌のことを指します。 残りの数は、外分泌腫瘍(膵嚢胞がんなど)と内分泌腫瘍(膵島細胞由来)に分けられます。
膵臓がんは死亡率が高く、英国におけるがん死亡の4番目に多い原因になっています。 40歳以下ではまれで、60~80歳代で80%が発症します。
今回は、膵臓がん患者の危険因子、検査、管理について見ていきます。
病態生理
膵臓がんの最も多いタイプは管状がんです(膵臓原発悪性腫瘍の9割を占める)。
がんが広がると、局所構造への直接浸潤は、一般的に脾臓、横行結腸、および副腎を含みます。 リンパ節転移は、典型的には、局所リンパ節、肝臓、肺、および腹膜を含む。
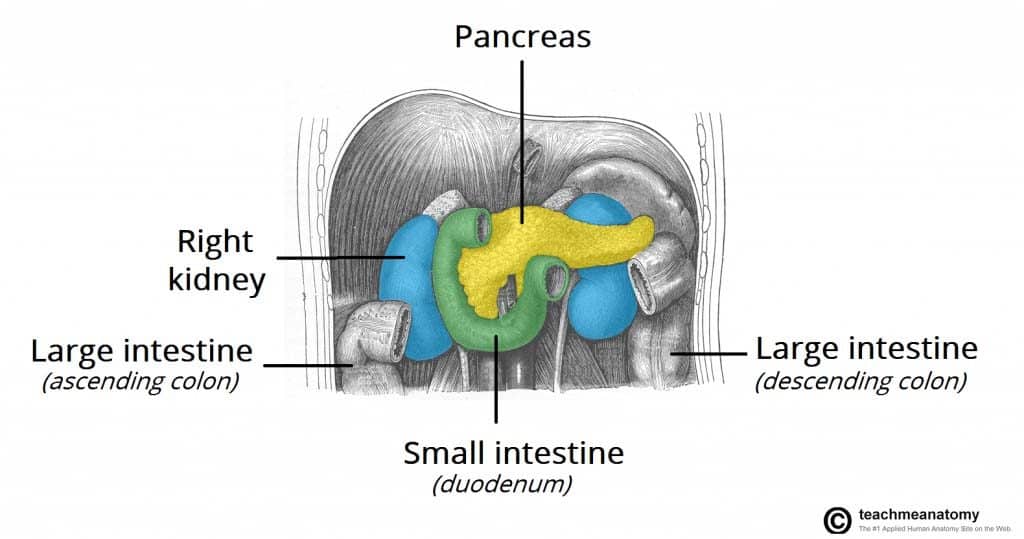 図1-膵臓がんは、脾臓、横行結腸、副腎などの周囲の構造物に直接転移することがある。
図1-膵臓がんは、脾臓、横行結腸、副腎などの周囲の構造物に直接転移することがある。危険因子
膵臓がん発症の明確な危険因子はほとんどない。 特定されているものには、喫煙と慢性膵炎がある。 また、患者の7%に家族歴があることから、遺伝的要素もあるかもしれない。
遅発性糖尿病はさらなる危険因子である。
臨床症状
膵臓がんの症例の約80%は診断時に切除不能であり、これはその症状が遅く、しばしば曖昧で非特異的であることの証左であるとされています。
特異的な臨床的特徴*は腫瘍の部位によって異なります。
- 閉塞性黄疸-総胆管の圧迫による(診断時に症例の90%に認められる)、通常無痛
- 体重減少-がんの代謝作用によるもの。 または外分泌機能障害によるもの
- 腹痛(非特異的)-腸管叢への浸潤または膵炎によるもの
それほど多くはないが、急性膵炎または遊走性血栓性静脈炎(腫瘍随伴性血液凝固促進状態による再発性遊走性表面血栓性静脈炎)などがみられる。
*膵尾部の腫瘍は、経過が緩慢で、晩期まで症状が出ないことが多い
診察では、患者は悪液質、栄養失調、黄疸がみられることがある。 触診では、心窩部腫瘤、胆嚢腫大(Courvoisierの法則)
Courvoisier の法則
Courvoisier の法則では黄疸と腫大した胆嚢の存在で、触診可能であるとしています。 胆石が原因とは考えにくいため、胆道や膵臓の悪性腫瘍を強く疑う必要がある。
腫瘍が膀胱管より遠位にある場合、この徴候を認めることがある。
鑑別診断
膵臓癌は曖昧で非特異的な特徴を示すことが多く、胆嚢の大きさは膵臓癌患者の25%以下です。 鑑別診断は膨大で、以下のようなものがある。
- 閉塞性黄疸の原因-胆石症、胆管癌、良性胆嚢狭窄
- 心窩部腹痛の原因-胆石症、消化性潰瘍、胃癌
- 胃癌の原因-胆石症、消化性潰瘍、胃癌
- 胃癌の原因-胆石症、消化性潰瘍、良性胆嚢狭窄
- 腹痛の原因-胃癌、胃癌
検査
臨床検査
膵臓癌を疑う場合、FBC(貧血または血小板減少)およびLFT(ビリルビン、アルカリホスファターゼおよびガンマGTの上昇、閉塞性黄疸像の表示)などの初期血液検査の必要性があります。
CA19-9 は膵臓癌に対して高い感度と特異度を持つ腫瘍マーカーであるが、その役割は初期診断よりもむしろ治療に対する反応を評価することにある。
画像診断
膵臓癌の最初の画像診断は一般的に腹部超音波検査で、膵瘤または拡張胆道(非常に末期の場合は潜在的肝転移と腹水も含めて)を示す場合がある。
CT画像(膵臓プロトコルを使用、図2)は、診断上最も重要な検査であると同時に、病勢を把握できるため、予後的にも最も有益な検査である。 CTで病変が限局しており、今後がん治療を行う予定の患者さんにはPET-CT検査が必要となる場合があります
診断がはっきりしない場合は、病変を組織学的に評価するために内視鏡的超音波検査(EUS)が行われることがあります。 また、適切な場所であれば、生検や細胞診のためにERCPを用いることもできます*9121>
*ERCPで胆道閉塞を解除し、組織診断がつかない場合は細胞診のための胆汁ブラッシングを行う。
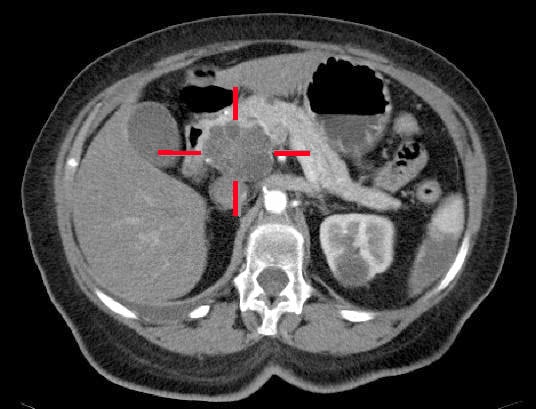 図2 膵頭部に位置する腺癌、CTスキャンで確認
図2 膵頭部に位置する腺癌、CTスキャンで確認Management
Surgery
治癒管理としては現在根治切除のみであります。
- 膵頭部の腫瘍の場合、治癒を目的とした最も一般的な手術は、ウィップル手術としても知られる膵頭十二指腸切除術です
- 特定の症例では幽門保存切除も試みられます
- 膵体部または膵尾部の腫瘍の場合、次のようになります。 手術の絶対禁忌は腹膜、肝臓、遠隔転移などです。 9121>
コクランレビューでは、局所進行膵臓癌で静脈浸潤がある患者において、十分な臨床的専門知識があれば、膵切除は緩和治療と比較して生存率を高め、費用を削減することが明らかになった。
ウィップル手術
ウィップル手術では、膵頭部、胃の前門、十二指腸の第1、2部、総胆管、胆嚢の切除を行います。
手術で摘出されたすべての臓器は、膵頭部と十二指腸に共通の動脈(胃十二指腸動脈)から供給されているため、摘出が行われます。
その後、膵尾部と肝管は空腸に接続され、胆汁と膵液が腸に排出されるようになり、胃は空腸に吻合されて食物の通過が可能になります。 A:術前、B:術後
化学療法
術後には、ESPAC-1試験*で生存率が向上することが証明された、5-フルオロウラシルを用いた補助化学療法が推奨されます。
転移性疾患では、パフォーマンスステータスが良好な患者にはFOLFIRINOX療法(フォリン酸、5-フルオロウラシル、イリノテカン、オキサリプラチン)の使用が推奨されるが、生存率はわずかに改善したのみである;FOLFIRINOXに耐えられない局所進行膵癌患者にはゲムシタビン療法が検討できる。
*ESPAC-1 はまた、アジュバント化学放射線療法を受けた患者は、アジュバント化学療法単独で治療を受けた患者よりも全生存率が悪いことを証明した。
緩和ケア
膵臓がん患者の大多数は治癒的手術の候補ではなく、緩和ケアの関与を必要とする。
閉塞性黄疸および関連する掻痒感は、ERCPまたは経皮的に胆汁ステントを挿入することにより軽減できる。
ゲムシタビンベースなどの緩和化学療法はパフォーマンス状態が妥当であれば、患者において試行することが可能である。
膵外分泌不全は、進行した患者や膵臓を大きく切除した患者でよく見られ、吸収不良や脂肪漏を引き起こす。これは、まずクレオン®などの酵素補充剤(リパーゼを含む)で治療できる。 膵臓がんの予後は非常に悪く、全5年生存率は9826>5%となっています。
ポイント
- 膵臓がんは閉塞性黄疸、腹痛、体重減少を併発することが多い
- ほとんどの場合CTスキャンで初発するが生検による組織診断が必要である。 CA19-9は腫瘍マーカーで、病勢進行のモニタリングに用いられる
- 確実な管理は外科的切除である。 補助化学療法を併用することが多い
- 膵臓癌の5年生存率は5%未満
膵臓内分泌腫瘍
膵臓内分泌腫瘍は機能性と非機能性のものがあります。 機能性腫瘍は活発にホルモンを分泌し、その徴候および症状はこれに関連している一方、非機能性腫瘍は活発にホルモンを分泌せず、臨床的特徴は純粋にその悪性の広がりに関連している。
膵内分泌腫瘍はしばしば多発性内分泌腫瘍1症候群(MEN1)に関連している;MEN1は一般的に副甲状腺機能亢進症、膵内分泌腫瘍および下垂体腫瘍(最も一般的にはプロラクチノーマ)から構成されている。
臨床的特徴
細胞型 分泌ホルモン(腫瘍名) 正常生理機能 G 細胞 ガストリン(ガストリノーマ) 胃酸分泌促進 Zollinger- α 細胞 グルカゴン(グルカゴノーマ) 血糖値上昇 高血糖、糖尿病 。 と壊死性遊走性紅斑 β 細胞 インスリン(インスリノーマ) 血糖値低下 症状性低血糖症。 発汗や精神状態の変化など、炭水化物の摂取で改善する δ 細胞 Somatostatin (Somatostatinoma) GHの放出を抑制する。 下垂体前葉からのTSH、プロラクチン、ガストリン 糖尿病、脂肪肝、胆石(コレシストキニンの阻害による)、体重減少。 および無胃酸症(ガストリン阻害による) 非島細胞 血管作動性腸ペプチド(VIPoma) 腸に水分や電解質を分泌する。 腸管平滑筋の弛緩 長引く大量の水様性下痢、重度の低カリウム血症、脱水(Verner-Morrison症候群としても知られている) 表1 – 膵臓の内分泌腫瘍
調査
すべてのケースは管理指針が得られる多職種チームミーティングにかけられるべきでしょう。 膵NETは、CT画像、MRI画像、内視鏡超音波検査を組み合わせて検査することが望ましい。 インスリノーマやガストリノーマの位置確認や評価には、デジタルサブトラクション血管造影による動脈内カルシウムを使用することもあります。 より大きな腫瘍または機能している腫瘍は切除し、腫瘍が低悪性度で転移が低容量であれば、遠隔転移病巣も切除する。
ソマトスタチンアナログは、ホルモン分泌過多(ソマトスタチノーマの場合にも)の影響を制御し改善させるために使用されることがある。