学習目標
- アルコールの沸点が、同程度のモル質量のエーテルやアルカンよりも高い理由を説明できる。
- 炭素原子数4以下のアルコールとエーテルが水に溶け、同等のアルカン類は溶けない理由を説明できる。
アルコールは水(H2O、HOHとも書く)の誘導体と考えられる。

水のH-O-H結合と同様に、R-O-H結合は曲がり、アルコール分子は極性である。 この関係は特に低分子で顕著であり、モル質量の小さいアルコールの物理的、化学的性質に反映されている。 アルカンの水素原子をOH基で置き換えると、水素結合によって分子が会合するようになる(図(ⅶ))
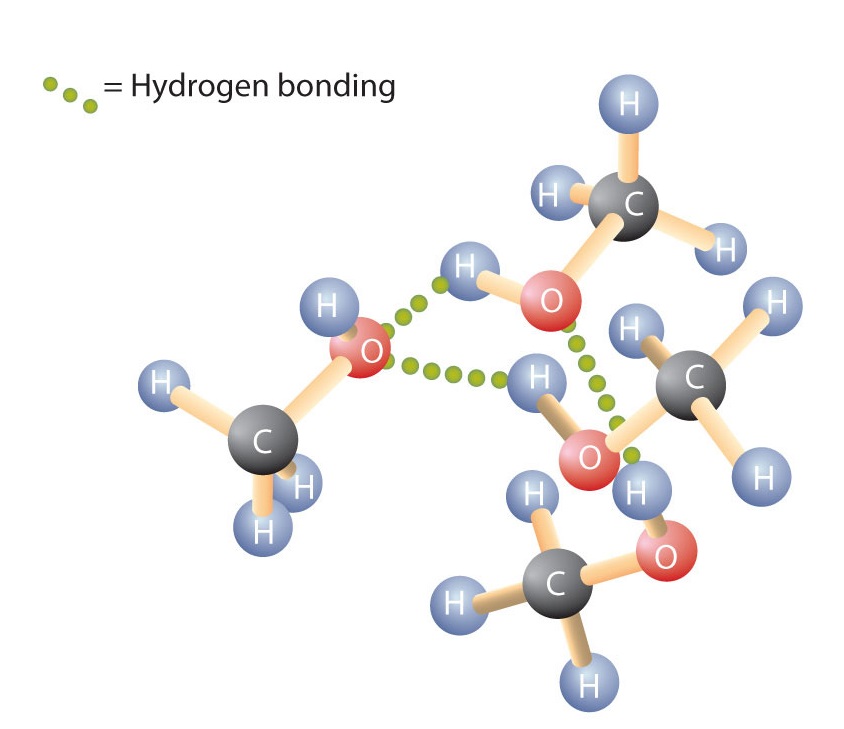
物性は分子間力の種類によって大きく左右されることがわかる。 表 ⑭は、一般的な化合物のモル質量と沸点です。 この表から、同じようなモル質量の物質でも沸点がかなり異なることがわかります。 沸点とモル質量の比較
Name
Boiling Point (°C)
水
-89
アルカンは無極性であるため、比較的弱い分散力によってのみ結合している。 炭素原子数1~4のアルカンは室温では気体である。 一方、炭素原子1個のメタノールでさえ、室温では液体である。 水素結合は、同モル量の炭化水素に比べ、アルコールの沸点を大きく上昇させる。 沸点は、液体の分子を最も近い隣人から引き離すのに必要なエネルギー量を大まかに示したものである。 分子が水素結合で相互作用している場合、その分子間引力を破壊するために比較的大きなエネルギーが供給されなければならない。
アルコールも水分子と水素結合をすることがあります(図(㊦))。 このように、炭化水素が水に溶けないのに対して、炭素原子数1~3のアルコールは完全に溶ける。 しかし、鎖の長さが長くなるにつれて、アルコールの水への溶解度は低下し、炭化水素に近づき、水には近づかなくなる。 1-デカノール(CH3CH2CH2CH2CH2CH2CH2CH2OH)というアルコールは、基本的に水に溶けない。 有機化合物では、炭素原子4個か5個が溶解度の境界となることがよくあります。
まとめ
アルコールはOH基によってアルコール分子が水素結合をするため、同じモル質量のエーテルやアルカンより沸点が高くなる。 炭素原子数が4以下のアルコールは、アルコール分子が水分子と水素結合をするため、水に溶けるが、同等のアルカン分子は水素結合をすることができない。
Concept Review Exercises
-
なぜエタノールは1-ヘキサノールより水に溶けるのか?
-
1-butanol is a lower boiling point than 1-hexanolはなぜ1-ブタノールの方が低いのか?
回答
-
エタノールにはOH基と炭素原子2個しかなく、1ヘキサノールには炭素原子6個に対してOH基1個のためエタノールよりも(非極性の)炭化水素に近くなっているためです。
-
1-ヘキサノールのモル質量は1-ブタノールのモル質量より大きい。
練習問題
本文中の表を参照せずに、以下の練習問題に答えよ。
-
これらのアルコールを沸点の高い順に並べて、エタノール、メタノール、1-プロパノールとせよ。
-
沸点が高いのはブタンと1-プロパノールですか?
-
水に溶ける量が多い順に、1-ブタノール、メタノール、1-オクタノールと並べてみてください。
-
これらの化合物を水に対する溶解度の高い順に並べると、1-ブタノール、エタノール、ペンタンになります。
答え
-
メタノール < エタノール < 1-ブタノールプロパノール
-
1-オクタノール < 1-ブタノール < メタノール