Autoregulation of Cerebral Blood Flow
Autoregulation of cerebral blood flow is the ability of brain to maintain relatively constant blood flow despite changes in perfusion pressure. 自動調節機能は多くの血管床に存在するが、特に脳で発達している。これは、一定の血液供給と水の恒常性が必要であるためと考えられる。 正常血圧の成人では、CPPが〜60〜160mmHgの範囲であれば、脳血流は脳組織100gあたり毎分〜50mLに維持される。 この値を超えると自動調節機能が失われ、脳血流は平均動脈圧に直線的に依存するようになる。 CPPが自動調節の下限を下回ると、脳虚血となる。 脳血流の減少は、血液からの酸素抽出量の増加によって補われる。 虚血の臨床的徴候や症状は、灌流の減少が酸素抽出の増加による代謝の必要性を超えるまで現れない。 この時点で、めまい、精神状態の変化、最終的には不可逆的な組織損傷(梗塞)などの低灌流の臨床徴候が生じる。 神経細胞の関与が期待されるが、交感神経と副交感神経を遮断した動物では脳血流の自動調節が保たれていることから、外因性の神経因子が脳血流の自動調節に大きく関与しているとは考えられない(血管周囲神経を参照)。 最近,神経細胞の一酸化窒素が脳血流の自動調節に関与することが示され,外因性神経支配は関与しないが内因性神経支配が関与している可能性が示唆されている. また、代謝の二次産物が自動調節に関与している可能性も指摘されています。 脳血流の低下により、脳から血管作動物質が放出され、動脈が拡張される。 この血管作動性物質の候補としては、H+、K+、O2、アデノシンなどが挙げられる。 圧力が自己調節曲線の上端で変動しているときの脳血流の自己調節は、圧力上昇に対応して収縮し、圧力低下に対応して拡張する脳平滑筋の筋原性挙動によるものと思われる 。 筋原性活動が自己調節に重要な寄与をしていることは、圧力上昇に反応して収縮し、圧力低下に反応して拡張する単離・加圧した脳動脈においてin vitroで証明されている(「筋原性反応」の項参照)。 筋原性圧力範囲より低い圧力での自動調節には、おそらく低酸素と代謝因子の放出が関与している。
正常な脳機能における自動調節の重要性は、自動調節機構が失われると重大な脳障害が発生するという事実によって強調されている。 例えば、自己調節限界を超える圧力での急性高血圧時には、血管平滑筋の筋原性収縮が過剰な血管内圧に打ち勝ち、脳血管の強制拡張が起こる 。 この強制拡張時に筋緊張が消失することにより脳血管抵抗が低下し、脳血流量が300~400%と大きく増加する(図16)。 また、脳血管抵抗の低下は脳内皮の静水圧を増加させ、高血圧性脳症、後可逆性脳症症候群(PRES)、子癇などの基礎疾患である浮腫形成を引き起こす(血管原性浮腫形成の項を参照)。
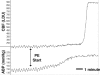
FIGURE 16
PE投与量増加に対するCBF(レーザードップラー単位)とABP(mmHg単位)のトレースです。 この実験では、ABPが140mmHgから210mmHgに増加すると、CBFはベースラインより4倍増加し、自動調節の突破が証明された。 使用例(詳細)
有効な降圧療法の出現以来まれではあるが、高血圧性脳症は、脳血流自動調節の上限(>160mmHg)を超えるほどの急激で持続した血圧の上昇の結果として発生する。 高血圧に対する脳血管の反応に関する初期の研究により、高血圧性血管攣縮という概念が生まれた。 急性高血圧性脳症は、脳動脈のスパズム(血管収縮が制御されない状態)により、脳組織が虚血に陥ったと考えられた。 この考え方は、実験的に腎臓の高血圧を作り、神経症状を示した高血圧ラットの約90%に皮質のトリパンブルー滲出斑が多数認められたが、脳症状のないラットでは脳血管の透過性は正常であったByromの観察から生まれたものである。 また、脳血管の透過性は正常であった。さらに、脳血管の血管収縮と血管拡張が交互に起こり、ソーセージストリングと呼ばれる現象が観察された。 このことから、彼は、脳血管攣縮が急性高血圧に反応して虚血と浮腫の形成を引き起こすと結論づけた。 その後、Byromは、腸間膜循環において、この「ソーセージ・ストリング」外観を呈する血管の拡張部のみにタンパク質の漏出が見られるという所見に触れ、見解を改めた。 以来、高血圧によって脳血流が増加し「自動調節の突破」が起こることが立証されたのである。 さらに、高血圧性脳症では、痙攣よりも強制的な拡張の際に筋原性血管収縮が失われることが重要なイベントであることが実験的に確認された
。