化学元素ヘリウムは希ガスおよび非金属として分類されます。 1895年にウィリアム・ラムジーによって発見されました。

Data Zone
| 分類される。 | ヘリウムは希ガスで非金属 | |
| 色:無色 | ||
| 原子量: | 4.0%(0.1%)、 | |
| 色:無色 (1.0%)00260 | ||
| 状態: | 気体 | |
| 融点: | ||
| 注:通常大気圧では固まらないので融点も存在しない。 融点は25気圧の場合。 | ||
| 沸点: | -268.9 oC, 4.2 K | |
| 電子: | 2 | |
| プロトン: | 2 | |
| 最も多い同位体で中性子を発生する。 | 2 | |
| 電子殻: | 2 | |
| 電子配置: | 1s2 | |
| 密度 @ 20o C: | 0.0001787 g/cm3 | |
以下を含む、もっと表示する。 熱、エネルギー、酸化、
反応、化合物、半径、導電率
| 原子量: | 27.2 cm3/mol |
| 構造: | 通常六角形の密充填 |
| (v.)、 | 、 | 、 | 。ヘリウムを固めるのに必要な高い圧力) |
| 比熱容量 | 5.193 J g-1 K-1 |
| 融合熱 | 0.0138 kJ mol-1 |
| 霧化熱 | 0 |
| 気化熱 | 0.0845 kJ mol-1 |
| 1次イオン化エネルギー | 2372.3 kJ mol-1 |
| 第2イオン化エネルギー | – |
| 第3イオン化エネルギー | – |
| 電子親和力 | 0 kJ mol-。1 |
| 最小酸化数 | 0 |
| Min. Common oxidation no. | 0 |
| Maximum oxidation number | 0 |
| Max.Common oxidation no. | 0 |
| Max. | 0 |
| 電気陰性度(Pauling Scale) | – |
| 分極率体積 | 0.198 Å3 |
| 空気との反応 | なし |
| 15 M HNO3との反応 | なし |
| 6M硝酸との反応 | なし |
| 6M NaOHとの反応 | なし |
| 酸化物 | なし |
| ヒドリド (類) | なし |
| 塩化物(s) | なし |
| 原子半径 | 31 pm |
| イオン半径(1+イオン) | – |
| イオン半径(2+イオン) | – |
| イオン半径(3+イオン) | – |
| イオン半径(1-イオン) | – |
| イオン半径(2-イオン) | – |
| イオン半径(3-イオン) | – |
| 熱伝導率 | 0.15 W m-1 K-1 |
| 電気伝導率 | – |
| 氷点/融点: |

Nasa: 太陽の彩層で約6万℃の電離ヘリウム原子がこの画像で見られる紫外線を放射していることがわかります。
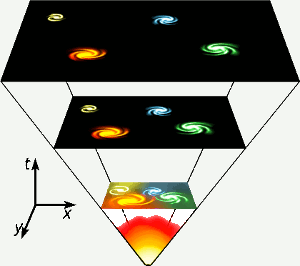
ヘリウムは宇宙が誕生して最初の3分間、あらゆる場所で核融合が起こるほど温度が高かったときに作られました。 この短い、高エネルギー段階は図の一番下に表されています。 ヘリウムは、私たちの星のような星で水素の核融合によっても作られる。 画像はイメージです。 Gnixon
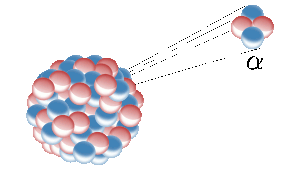
地球上のヘリウムは、ウランのような放射性元素の核分裂から生まれます。 ここでは、放射性核種がヘリウム核(アルファ粒子とも呼ばれる)を放出している。 画像はイメージです。 Inductiveload

ヘリウムのスペクトル、黄色の線が目立つ。 画像はイメージです。 Nasa

William Ramsay氏が指差す周期表の最後の列には、希ガス(または不活性ガス)が含まれています。 ラムジーは、不活性ガスの発見により、1904年にノーベル化学賞を受賞した。 画像はイメージです。 Vanity Fair
Discovery of Helium
ヘリウムの発見の物語は、星の性質の発見と絡み合っているのだそうです。
一時は、星が何からできているかはわからないと信じられていました。 1835年、フランスの哲学者オーギュスト・コントは、”我々はいかなる手段によっても、その化学組成を研究することはできないだろう “と宣言した。 (1)
コンテは、星の物質を実験室に入れることができれば、それが何であるかを知ることができると考えていた。
コンテの悲観論にもかかわらず、ヘリウムと星の組成を発見する方法はすでに見つかっていたのである。 1814年、ドイツの物理学者ヨーゼフ・フラウンホーファーは、アイザック・ニュートンのプリズムを用いた太陽光の分割方法を取り入れ、決定的な進歩を遂げた。 フラウンホーファーは、プリズムで分割された太陽光から出る虹色の中に、暗い線があることに気づいたのである。 (2), (3)
1859/60年、ドイツの科学者グスタフ・キルヒホフとロベルト・ブンセンは、フラウンホーファーが見た暗線が物質の指紋のようであることを発見するなど、分光学の分野で大きな飛躍を遂げました。 キルヒホッフとブンゼンは、太陽のスペクトルを見て、その輝く大気中に鉄が存在すると結論づけることができたのである。 (4)
ヘリウムの発見には、もう数年必要であった。 フランスの天文学者ピエール・ヤンセンは、分光器を使って太陽コロナ中のプロミネンスを観測するために、日食を待っていたのである。 日食後の2週間、ヤンセンは日食がなくてもプロミネンスのスペクトルを記録する方法を開発した。 その結果、黄色い線が観測された。 (5)
この線は、ナトリウムのスペクトルの線と似ているが同じではない位置にあった。 これをD1線、D2線と呼ぶことにした。 イギリスの科学者ノーマン・ロッキーは、この新しい黄色の線を研究し、後にD3線と呼ばれるようになる。彼は、この線が新しい元素によるものかもしれないと考え、その研究を発表した:
“…so then we knew that we were not dealing with hydrogen; hence we had to do with an element which we could not get in our laboratories, and therefore I took on responsibility of coining the helium, in first instance for laboratory use”. (6)
ヘリウムという名前は、ギリシャ語で太陽を意味するheliosに由来する。
Lockyerと彼の同僚であるEdward Franklandは、黄色の線の原因として考えられる他の考えを数多く持っていたので、新しい元素を発表しなかった。
1871年までに他の科学者は状況を知っていた。 ケルビン卿は、”太陽の周りを回る光る水素と「ヘリウム」の光の反射 “について議論した。 ヘリウム’の使用は、それを説明する脚注に続いている:
“フランクランドとロッキヤーは、黄色のプロミネンスがDから遠くないところに非常にはっきりとした明るい線を与えることを発見したが、これまでいかなる地上の炎とも識別されなかった。 それは新しい物質を示しているようで、彼らはそれをヘリウムと呼ぶことを提案している。” (7)
しかしながら、ヘリウムの存在は、すべての人に受け入れられたわけではなかった。 (5)
スコットランドの化学者ウィリアム・ラムジーが1895年にロンドンでヘリウムを分離したとき、すべての疑問が払拭された。 ラムジーは1894年にアルゴンを共同発見しており、アルゴンは希ガスの中で最初に発見されたガスであった。 1895年、彼はウラン鉱物のウラナイトに酸を加えると反応しないガスが発生するというウィリアム・ヒルブランドの論文に目を通した。 ヒレブランドは、この気体が窒素であると考えた。
このガスがアルゴンであると考えたラムジーは、別のウラン鉱物であるクレバイトを使ってヒレブランドの実験を繰り返し、ガスを採取した。
彼の分光器からは、窒素、アルゴン、その他1つのガスが検出された。 ラムジーは、D3線があるように見えたので、ヘリウムではないかと疑った。 (8) LockyerとWilliam Crookesが自分より優れた分光器を持っていることを知り、彼らにガスのサンプルを送った。 残念ながらサンプルは適当でなかったので、ロッキャーはウラナイトのサンプルを入手し、ガスを抽出して分光器で研究した。 彼はこう書いている。 (8)
「1868年に私が太陽で観察した未知の線が、一つずつガスのものであることがわかった」
ガスのスペクトルは太陽の「ヘリウム」と同じであった。 新しい元素が周期表の地位を勝ち取ったのです。
Chemicool’s Cool Helium Facts Page.

外観と特徴
有害な作用。
ヘリウムに毒性があることは知られていません。
特徴:
ヘリウムは軽く、無臭、無色、不活性な単原子ガスである。
他の元素と異なり、ヘリウムは固化せず、通常の圧力下では絶対零度(0K)まで液体のままである。
ヘリウムを一時的に吸った人の声は甲高く聞こえます。
ヘリウムの用途
ヘリウムの最大の用途は磁気共鳴画像装置(MRI)です。 ヘリウムはMRIスキャナーの超伝導磁石を冷却するために使われます。
ヘリウムは気球(ブリム)の充填や液体燃料ロケットの加圧に使われます。
ヘリウムと酸素の混合物は、ダイバーやその他の圧力下で働く人々の人工の「空気」として使われます。 長時間のダイビングの後、ヘリウムは窒素よりも早く体外に排出され、減圧が早くできるため、通常の空気中の窒素の代わりにヘリウムが使われます。
アーク溶接の周辺にガスシールドとして使われ、例えば、高温金属の溶接部が酸素と反応しないようにします。 半導体産業では、シリコンやゲルマニウムの結晶を成長させるための不活性ガスとして使用されています。 また、チタンやジルコニウムの製造における高温ガスや、ガスクロマトグラフィーにおけるキャリアガスとしても使用されている。
存在量と同位体
存在量地殻:重量で8ppm、モル数で43ppm
存在量太陽系:重量で23%、モル数で7.4%
コスト、純粋:100gあたり5.2ドル
コスト、バルク:100gあたりドル
源流は? 地球上のほぼすべてのヘリウムは、放射性崩壊の結果である。 ヘリウムの主な供給源は、テキサス州、オクラホマ州、カンザス州の井戸にある天然ガス鉱床からです。 ヘリウムは、最大7%のヘリウムを含む天然ガスの分別蒸留によって抽出される。
同位体。 ヘリウムには半減期がわかっている同位体が8種類あり、質量数は3から10である。

- Auguste Comte, Cours de Philosophie Positive at Project Gutenberg
- Keith J. Laidler, The World of Physical Chemistry, 1993, p179.この2つの安定同位体混合物は天然にはそれぞれ 0.0001% と 99.999% の濃さで存在する。
- MIT Spectroscopyより「古典的分光法の時代」。
- Gerard G. Emch, Mathematical and Conceptual Foundations of 20th-Century Physics., 1984, Elsevier Science Publishers, p211
- Helge Kragh, The Solar Element.邦訳『太陽系元素』。 2009年、Annals of Science, 66:2, p157-182.
- J. Norman Lockyer, The Growth of our Knowledge of Helium. Thomson, Presidential Address, British Association for the Advancement of Science, 1871, (Address. XCIX).
- Sir Norman Lockyer, The Sun’s Place in Nature.邦訳『自然界における太陽の位置』(岩波書店), 1897, p47-48
Cite this Page
オンラインリンクの場合は、以下のいずれかをコピー&ペーストしてください:
<a href="https://www.chemicool.com/elements/helium.html">Helium</a>
or
<a href="https://www.chemicool.com/elements/helium.html">Helium Element Facts</a>
学術文書でこのページを引用するには、以下の MLA 準拠引用符を使ってください:
"Helium." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/helium.html>.