Leerdoelen
- Uitleggen waarom de kookpunten van alcoholen hoger zijn dan die van ethers en alkanen van vergelijkbare molaire massa’s.
- Uitleggen waarom alcoholen en ethers van vier of minder koolstofatomen oplosbaar zijn in water terwijl vergelijkbare alkanen niet oplosbaar zijn.
Alcoholen kunnen worden beschouwd als derivaten van water (H2O; ook geschreven als HOH).

Zoals de H-O-H binding in water, is de R-O-H binding gebogen, en zijn alcoholmoleculen polair. Deze relatie is vooral duidelijk in kleine moleculen en komt tot uiting in de fysische en chemische eigenschappen van alcoholen met een lage molaire massa. Door een waterstofatoom van een alkaan te vervangen door een OH-groep kunnen de moleculen zich met elkaar verbinden door waterstofbruggen (figuur).
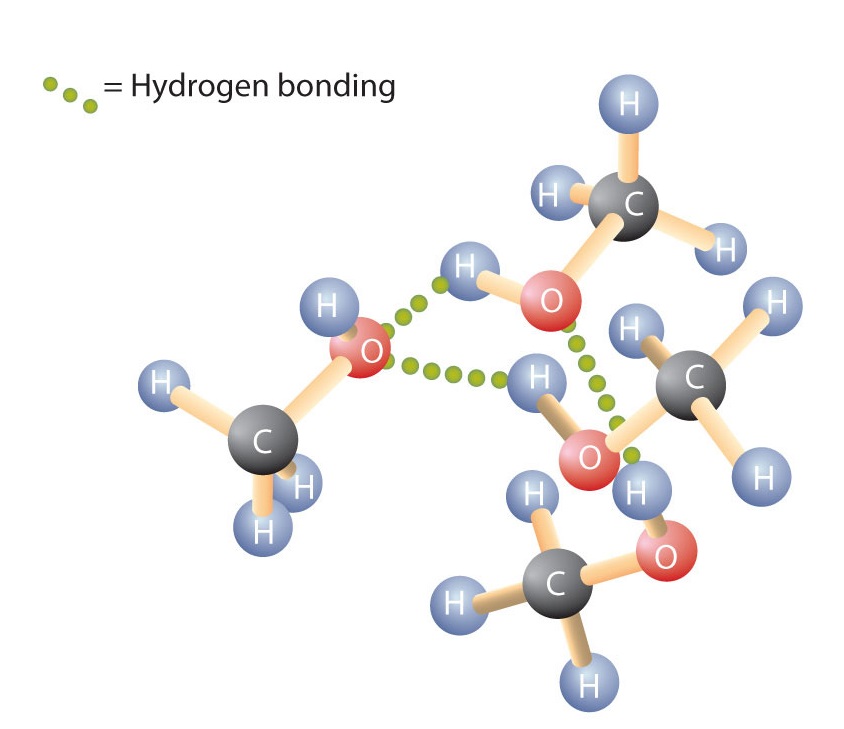
Opgemerkt moet worden dat fysische eigenschappen voor een groot deel worden bepaald door het type intermoleculaire krachten. In tabel 1 staan de molaire massa’s en de kookpunten van een aantal veel voorkomende verbindingen. Uit de tabel blijkt dat stoffen met vergelijkbare molaire massa’s toch heel verschillende kookpunten kunnen hebben.
| Formule | Naam | Molaire Massa | Kookpunt (°C) |
|---|---|---|---|
| CH4 | methaan | 16 | -164 |
| HOH | water | 18 | 100 |
| C2H6 | ethaan | 30 | -89 |
| CH3OH | methanol | 32 | 65 |
| propaan | 44 | -42 | |
| CH3CH2OH | ethanol | 46 | 78 |
| C4H10 | butaan | 58 | -1 |
| CH3CH2CH2OH | 1-propanol | 60 | 97 |
Alkanen zijn niet polair en worden dus alleen geassocieerd door relatief zwakke dispersiekrachten. Alkanen met één tot vier koolstofatomen zijn gassen bij kamertemperatuur. Daarentegen is zelfs methanol (met één koolstofatoom) een vloeistof bij kamertemperatuur. Waterstofbinding verhoogt het kookpunt van alcoholen aanzienlijk in vergelijking met koolwaterstoffen van vergelijkbare molaire massa. Het kookpunt is een ruwe maatstaf voor de hoeveelheid energie die nodig is om een vloeistofmolecuul te scheiden van zijn naaste buren. Als de moleculen op elkaar inwerken door waterstofbruggen, moet een relatief grote hoeveelheid energie worden toegevoerd om die intermoleculaire aantrekkingskracht te verbreken. Alleen dan kan het molecuul uit de vloeistof ontsnappen naar de gasvormige toestand.
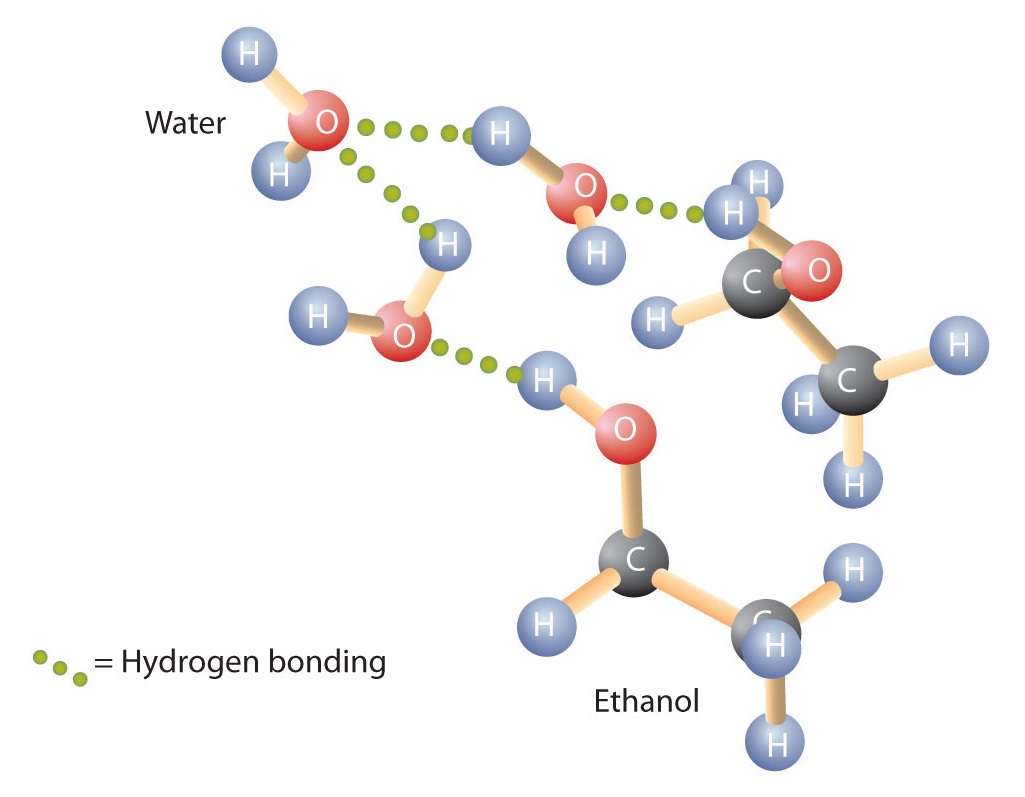
Alcoholen kunnen ook waterstofbindingen aangaan met watermoleculen (Figuur \(\PageIndex{2}\)). Terwijl koolwaterstoffen dus onoplosbaar zijn in water, zijn alcoholen met één tot drie koolstofatomen volledig oplosbaar. Naarmate de lengte van de keten toeneemt, neemt de oplosbaarheid van alcoholen in water echter af; de moleculen gaan meer op koolwaterstoffen lijken en minder op water. De alcohol 1-decanol (CH3CH2CH2CH2CH2CH2CH2CH2CH2CH2OH) is in wezen onoplosbaar in water. Vaak zien we dat de grens van oplosbaarheid in een familie van organische verbindingen ligt bij vier of vijf koolstofatomen.
Samenvatting
Alcoholen hebben een hoger kookpunt dan ethers en alkanen van vergelijkbare molaire massa’s omdat de OH-groep alcoholmoleculen in staat stelt waterstofbruggen aan te gaan. Alcoholen met vier of minder koolstofatomen zijn oplosbaar in water omdat de alcoholmoleculen waterstofbruggen aangaan met watermoleculen; vergelijkbare alkaanmoleculen kunnen geen waterstofbruggen aangaan.
Oefeningen voor begripsherziening
-
Waarom is ethanol beter oplosbaar in water dan 1-hexanol?
-
Waarom heeft 1-butanol een lager kookpunt dan 1-hexanol?
Antwoorden
-
Ethanol heeft een OH-groep en slechts 2 koolstofatomen; 1-hexanol heeft één OH-groep voor 6 koolstofatomen en lijkt dus meer op een (niet polaire) koolwaterstof dan ethanol is.
-
De molaire massa van 1-hexanol is groter dan die van 1-butanol.
Oefeningen
Beantwoord de volgende oefeningen zonder tabellen in de tekst te raadplegen.
-
Rangschik deze alcoholen in volgorde van oplopend kookpunt: ethanol, methanol, en 1-propanol.
-
Welke heeft het hoogste kookpunt: butaan of 1-propanol?
-
Rangschik deze alcoholen in volgorde van toenemende oplosbaarheid in water: 1-butanol, methanol, en 1-octanol.
-
Rangschik deze verbindingen in volgorde van toenemende oplosbaarheid in water: 1-butanol, ethanol, en pentaan.
Antwoorden
-
methanol < ethanol < 1-propanol
-
1-octanol < 1-butanol < methanol