Leerdoelen
- De relatie kennen tussen de zuur- of basesterkte en de grootte van de K_a, K_b, pK_a, en pK_b.
- Om het nivelleringseffect te begrijpen.
De grootte van de evenwichtsconstante voor een ionisatiereactie kan worden gebruikt om de relatieve sterkten van zuren en basen te bepalen. Zo luidt de algemene vergelijking voor de ionisatie van een zwak zuur in water, waarbij HA het moederzuur is en A- de geconjugeerde base, als volgt:
De evenwichtsconstante voor deze dissociatie is als volgt:
}{}
Zoals eerder opgemerkt is de waterconcentratie voor alle reacties in een waterige oplossing in essentie constant, zodat \(\) in vergelijking \(\ref{16.5.2}}) kan worden opgenomen in een nieuwe grootheid, de zuurionisatieconstante (\(K_a\)), ook wel de zuurdissociatieconstante genoemd:
=\dfrac{}{} \De numerieke waarden van K en K_a verschillen dus door de concentratie van water (55,3 M). Nogmaals, voor de eenvoud kan H3O^+ worden geschreven als H^+ in vergelijking. Bedenk wel dat vrij H^+ niet bestaat in waterige oplossingen en dat in alle zure ionisatiereacties een proton wordt overgedragen aan H2O om hydroniumionen te vormen, H3O^+. Hoe groter de K_a, hoe sterker het zuur en hoe hoger de H^+ concentratie bij evenwicht. Zoals alle evenwichtsconstanten worden ook de zuur-base ionisatieconstanten gemeten in termen van de activiteit van φ(H^+) of φ(OH^-), waardoor ze eenheidsloos zijn. De waarden van K_a voor een aantal veel voorkomende zuren zijn gegeven in Tabel.
Zwakke basen reageren met water tot het hydroxide-ion, zoals blijkt uit de volgende algemene vergelijking, waarbij B de moederbase is en BH+ het geconjugeerde zuur:
De evenwichtsconstante voor deze reactie is de base-ionisatieconstante (Kb), ook wel de base-dissociatieconstante genoemd:
= \frac{}{}
Ook hier is de waterconcentratie constant, zodat deze niet in de evenwichtsconstante voorkomt; in plaats daarvan is deze opgenomen in de \(K_b). Hoe groter de \(K_b), hoe sterker de base en hoe hoger de concentratie OH^- bij evenwicht. De waarden van K_b voor een aantal veel voorkomende zwakke basen zijn gegeven in tabel
Er bestaat een eenvoudig verband tussen de grootte van K_a voor een zuur en K_b voor zijn geconjugeerde base. Beschouw bijvoorbeeld de ionisatie van blauwzuur (HCN) in water tot een zure oplossing, en de reactie van CN met water tot een basische oplossing:
De evenwichtsconstante voor de ionisatie van HCN is als volgt:
{}
De overeenkomstige uitdrukking voor de reactie van cyanide met water is als volgt:
}{}
Als we de vergelijkingen (\ref{16.5.6}\) en \(\ref{16.5.7}, krijgen we het volgende:
| Reactie | Equilibriumconstanten |
|---|---|
| (HCN_{(aq)}} \H^+{(aq)}+cancel{CN^-_{(aq)}} \K_a=CN^-_{(aq)}}+H_2O{(l)}} | |
| \OH^-_{(aq)}+HCN_{(aq)}}) | (K_b=(aq)}/(aq)}) |
| (H_2O_{(l)}}+H_2O{(l)}+H_2O{(l)}) | |
| (K_b=(aq)}+H_2O{(l)}) | |
| . \H^+_{(aq)}+OH^-_{(aq)}) | (K=K_a \times K_b=) |
In dit geval, is de som van de reacties beschreven door K_a en K_b de vergelijking voor de autoionisatie van water, en het product van de twee evenwichtsconstanten is K_w:
Als we dus òf (K_a) voor een zuur òf (K_b) voor zijn geconjugeerde base weten, kunnen we de andere evenwichtsconstante voor elk geconjugeerd zuur-base paar berekenen.
Net als bij pH, pOH en pKw kunnen we negatieve logaritmen gebruiken om exponentiële notatie te vermijden bij het schrijven van ionisatieconstanten voor zuren en basen, door \(pK_a\) als volgt te definiëren:
en \(pK_b) als
Op dezelfde manier is vergelijking \(pK_b) als volgt:
.5.10}, die het verband tussen \(K_a) en \(K_b) uitdrukt, kan in logaritmische vorm als volgt worden geschreven:
Bij 25 °C wordt dit
De waarden van \(pK_a) en \(pK_b) zijn voor enkele veel voorkomende zuren en basen gegeven in de tabellen \(\PageIndex{1}) en \(\PageIndex{2}), en een uitgebreidere reeks gegevens wordt gegeven in de tabellen E1 en E2. Door het gebruik van negatieve logaritmen corresponderen kleinere waarden van pK_a met grotere ionisatieconstanten van zuren en dus met sterkere zuren. Zo is bijvoorbeeld salpeterzuur (HNO2), met een pK van 3,25, ongeveer een miljoen keer sterker dan waterstofcyanide (HCN), met een pK van 9,21. Omgekeerd corresponderen kleinere waarden van \(pK_b) met grotere ionisatieconstanten van basen en dus met sterkere basen.
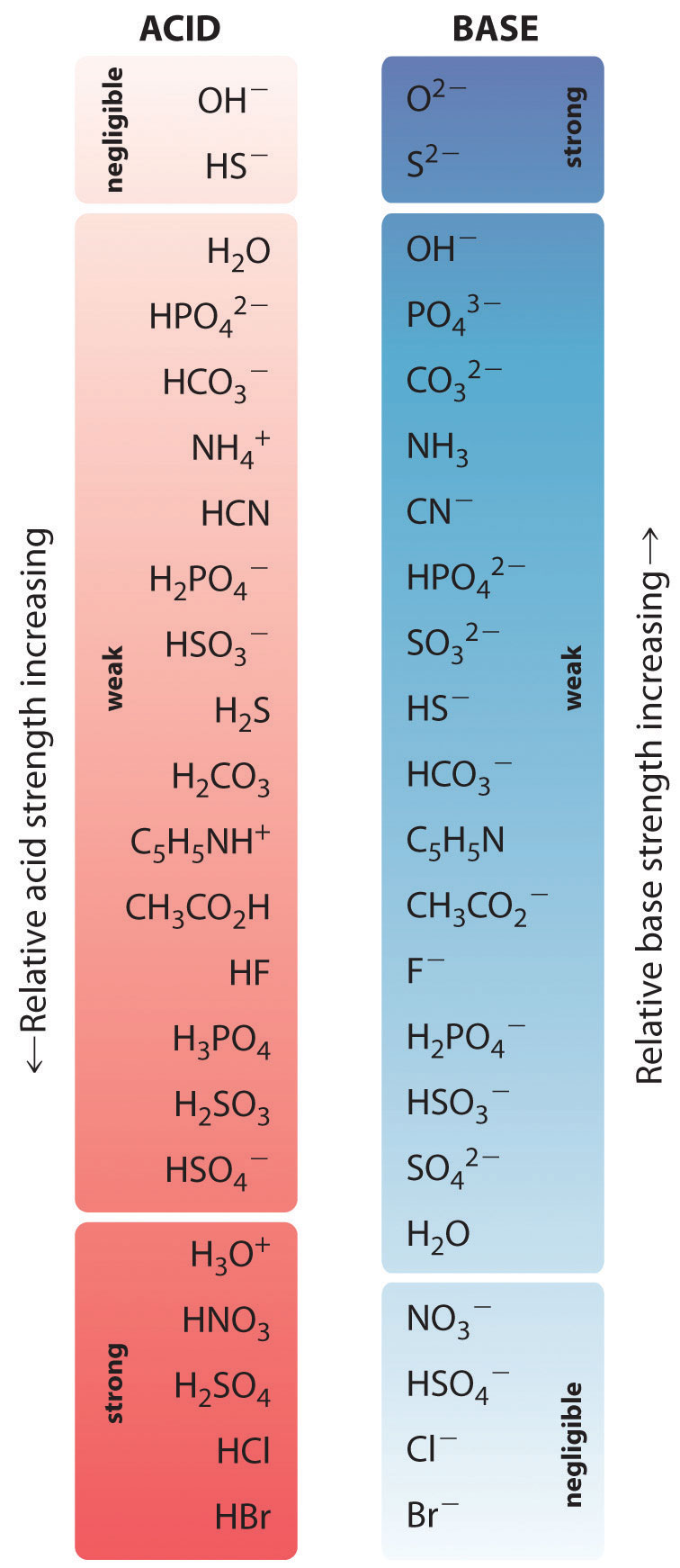
De relatieve sterkten van een aantal veel voorkomende zuren en hun geconjugeerde basen zijn grafisch weergegeven in figuur (\PageIndex{1}). De geconjugeerde zuur-basenparen zijn gerangschikt in volgorde (van boven naar beneden) van toenemende zuursterkte, hetgeen overeenkomt met afnemende waarden van pK_a. Deze volgorde komt overeen met afnemende sterkte van de geconjugeerde base of toenemende waarden van pK_b. Linksonder in figuur staan de meest voorkomende sterke zuren; rechtsboven staan de meest voorkomende sterke basen. Let op het omgekeerde verband tussen de sterkte van het moederzuur en de sterkte van de geconjugeerde base. De geconjugeerde base van een sterk zuur is dus een zeer zwakke base, en de geconjugeerde base van een zeer zwak zuur is een sterke base.
De geconjugeerde base van een sterk zuur is een zwakke base en omgekeerd.
We kunnen de relatieve sterkten van zuren en basen gebruiken om de richting van een zuur-base reactie te voorspellen door één enkele regel te volgen: een zuur-base evenwicht bevoordeelt altijd de kant met het zwakkere zuur en de zwakkere base, zoals aangegeven door deze pijlen:
In een zuur-base reactie reageert het proton altijd met de sterkere base.
Zuur bijvoorbeeld is een sterk zuur dat in een verdunde waterige oplossing vrijwel volledig ioniseert tot H3O+ en Cl+; slechts verwaarloosbare hoeveelheden HCl-moleculen blijven ongebonden. Het ionisatie-evenwicht ligt dus vrijwel helemaal naar rechts, zoals weergegeven door een enkele pijl:
Azijnzuur is daarentegen een zwak zuur, en water is een zwakke base. Bijgevolg bevatten waterige oplossingen van azijnzuur overwegend azijnzuurmoleculen in evenwicht met een kleine concentratie van (H_3O^+) en acetaationen, en ligt het ionisatie-evenwicht ver naar links, zoals weergegeven door deze pijlen:
Ook bij de reactie van ammoniak met water is het hydroxide-ion een sterke base, en ammoniak een zwakke base, terwijl het ammoniumion een sterker zuur is dan water. Daarom ligt dit evenwicht ook links:
Alle zuur-base-evenwichten bevoordelen de kant met het zwakkere zuur en de zwakkere base. Het proton is dus gebonden aan de sterkere base.
Voorbeeld: Butyraat- en Dimethylammoniumionen
- Bereken \(K_b) en \(pK_b) van het butyraation (\(CH_3CH_2CH_2CO_2^-\)). De pK van boterzuur bij 25°C is 4,83. Boterzuur is verantwoordelijk voor de vieze geur van ranzige boter.
- Bereken \(K_a) en \(pK_a) van het dimethylammoniumion (\((CH_3)_2NH_2^+)). De basisionisatieconstante (K_b) van dimethylamine (CH_3)_2NH) is 5,4 maal 10^{-4}) bij 25°C:
Vraag: overeenkomstige K_b en pK_b, K_a en pK_a
Strategie:
De constanten (K_a) en (K_b) zijn aan elkaar gerelateerd zoals weergegeven in Vergelijking \(\ref{16.5.10}\). Het verband tussen pK_a en pK_b voor een zuur en zijn conjugaat base staat in de vergelijkingen pK(\ref{16.5.15}) en pK(\ref{16.5.16}). Gebruik de relaties pK = -log K en K = 10-pK (vergelijkingen \(\ref{16.5.11}\) en \(\ref{16.5.13}\)) om te rekenen tussen \(K_a) en \(pK_a) of \(K_b) en \(pK_b).
Oplossing:
We krijgen de \(pK_a) voor boterzuur en er wordt gevraagd om de \(K_b) en de \(pK_b) voor zijn conjugaat base, het butyraat ion, te berekenen. Omdat de genoemde waarde voor pK_a bij een temperatuur van 25°C is, kunnen we de vergelijking gebruiken: \pK_a + pK_b = pKw = 14,00. Door de pK_a te substitueren en op te lossen voor pK_b, is pK_b gelijk aan 10 maal 10.
In dit geval krijgen we \(K_b) voor een base (dimethylamine) en wordt ons gevraagd om \(K_a) en \(pK_a) te berekenen voor zijn conjugaatzuur, het dimethylammoniumion. Omdat de aanvankelijk gegeven grootheid \(K_b) is en niet \(pK_b), kunnen we Vergelijking \(K_aK_b) gebruiken: \K_aK_b = K_w. Door de waarden van K_b en K_w bij 25°C in te vullen en op te lossen voor K_a,
Omdat pK_a = -log K_a, hebben we pK_a = -log(1,9 maal 10^{-11}) = 10,72). We hadden ook \(K_b) kunnen omrekenen naar \(pK_b) om hetzelfde antwoord te krijgen:
Als we een van deze vier grootheden voor een zuur of een base krijgen (\(K_a), \(pK_a), \(K_b), of \(pK_b)), dan kunnen we de andere drie berekenen.
Oefening:..: Melkzuur
Lactinezuur (CH_3CH(OH)CO_2H)) is verantwoordelijk voor de scherpe smaak en geur van zure melk; het zou ook spierpijn veroorzaken bij vermoeide spieren. De K.A. is 3,86 bij 25°C. Bereken (K_a) voor melkzuur en (pK_b) en \(K_b) voor het lactaation.
Antwoord
- (K_a = 1,4 maal 10^{-4}) voor melkzuur;
- (pK_b) = 10.14 en
- (K_a = 1,4 maal 10^{-4}) voor melkzuur;
- (pK_b) = 10.86 bij 25°C.14 en
- (K_b = 7,2 maal 10^{-11}) voor het lactaat ion
Oplossingen van sterke zuren en basen: Het nivelleringseffect
Je zult in Tabel zien dat zuren als H2SO4 en HNO3 boven het hydroniumion liggen, wat betekent dat ze een pK_a kleiner dan nul hebben en sterkere zuren zijn dan het H3O^+ ion. Herinner je uit hoofdstuk 4 dat het zure proton in vrijwel alle oxozuren gebonden is aan een van de zuurstofatomen van het oxoanion. Salpeterzuur zou dus eigenlijk geschreven moeten worden als ion(HONO_2). Helaas worden de formules van oxozuren bijna altijd geschreven met waterstof aan de linkerkant en zuurstof aan de rechterkant, wat resulteert in \(HNO_3). In feite hebben alle zes van de veel voorkomende sterke zuren die we in hoofdstuk 4 voor het eerst tegenkwamen waarden lager dan nul, wat betekent dat ze een grotere neiging hebben om een proton te verliezen dan het ion ion met de eigenschap H(H_3O^+). Omgekeerd zijn de geconjugeerde basen van deze sterke zuren zwakkere basen dan water. Bijgevolg liggen de proton-overdracht evenwichten voor deze sterke zuren ver naar rechts, en het toevoegen van om het even welk van de gemeenschappelijke sterke zuren aan water resulteert in een hoofdzakelijk stoichiometrische reactie van het zuur met water om een oplossing van het ion (H_3O^+) en de geconjugeerde basis van het zuur te vormen.
Een methode is het gebruik van een oplosmiddel zoals watervrij azijnzuur. Omdat azijnzuur een sterker zuur is dan water, moet het ook een zwakkere base zijn, met een geringere neiging om een proton te accepteren dan H_2O. Metingen van het geleidingsvermogen van 0.1 M oplossingen van zowel HI als HNO3 in azijnzuur laten zien dat HI volledig ontleedt, maar HNO3 slechts gedeeltelijk ontleedt en zich in dit oplosmiddel gedraagt als een zwak zuur. Dit resultaat vertelt ons duidelijk dat HI een sterker zuur is dan HNO_3. De relatieve volgorde van de zuursterktes en de benaderende K(pK_a)-waarden voor de sterke zuren bovenaan in tabel \(\PageIndex{1}}) zijn bepaald met behulp van metingen als deze en verschillende niet-waterige oplosmiddelen.
In waterige oplossingen is H3O+ het sterkste zuur en is OH^- de sterkste base die in evenwicht kan bestaan met H2O.
Het nivelleringseffect geldt ook voor oplossingen van sterke basen: In een waterige oplossing wordt elke base die sterker is dan OH- genivelleerd tot de sterkte van OH- omdat OH- de sterkste base is die in evenwicht met water kan bestaan. Zouten zoals K2O, NaOCH3 (natriummethoxide) en NaNH2 (sodamide of natriumamide), waarvan de anionen de geconjugeerde basen zijn van de stoffen die in de tabel onder water zouden staan, zijn allemaal sterke basen die in wezen volledig (en vaak heftig) reageren met water, waarbij ze een proton accepteren om een oplossing van OH en het bijbehorende kation te geven:
Andere voorbeelden die je kunt tegenkomen zijn kaliumhydride (\(KH\)) en organometaalverbindingen zoals methyllithium (\(CH_3Li\)).
Polyprotachtige zuren en basen
Zoals je geleerd hebt, bevatten polyprotachtige zuren zoals \(H_2SO_4), \(H_3PO_4), en \(H_2CO_3) meer dan één ioniseerbaar proton, en de protonen gaan stapsgewijs verloren. De volledig geprotoneerde soort is altijd het sterkste zuur, omdat het gemakkelijker is een proton uit een neutraal molecuul te verwijderen dan uit een negatief geladen ion. De zuurtegraad neemt dus af met het verlies van opeenvolgende protonen, en dienovereenkomstig neemt de pK_a toe. Neem bijvoorbeeld (H2SO4):
Het evenwicht in de eerste reactie ligt ver naar rechts, wat consistent is met het feit dat (H2SO4) een sterk zuur is. In de tweede reactie daarentegen zijn bij evenwicht zowel aanzienlijke hoeveelheden HSO4^- als SO4^2- aanwezig.
Voor een polyprotisch zuur neemt de zuursterkte af en de pKa toe met het opeenvolgende verlies van elk proton.
Het waterstofsulfaation (HSO_4^-) is zowel de geconjugeerde base van H2SO_4 als het geconjugeerde zuur van SO4^2-). Net als water kan HSO4- dus zowel een zuur als een base zijn, afhankelijk van het feit of de andere reactant een sterker zuur of een sterkere base is. Omgekeerd is het sulfaation (SO_4^{2-}) een polyprotische base die stapsgewijs twee protonen kan aannemen:
Net als bij elk ander geconjugeerd zuur-base paar zijn de sterkten van de geconjugeerde zuren en basen gerelateerd door \(pK_a) + \(pK_b) = pKw. Neem bijvoorbeeld het geconjugeerde zuur-base paar (HSO_4^-/ SO_4^{2}). Uit Tabel Tabel zien we dat de pK van HSO_4^- 1,99 is. Daarom is de pK van SO4^2- 14,00 – 1,99 = 12,01. Sulfaat is dus een tamelijk zwakke base, terwijl OH^- een sterke base is, zodat het evenwicht in Vergelijking 16.6 links ligt. Het ion HSO_4^- is ook een zeer zwakke base (pK_a van H2SO_4 = 2.0, pK_b van HSO4^- = 14 – (-2.0) = 16), wat overeenkomt met wat we verwachten voor de geconjugeerde base van een sterk zuur.
Voorbeeld:
Voorspel of het evenwicht voor elke reactie links of rechts ligt zoals geschreven.
- (NH^+_{4(aq)}+PO^{3-}_{4(aq)}) \rightleftharpoons NH_{3(aq)}+HPO^{2−}_{4(aq)}\)
- \(CH_3CH_2CO_2H_{(aq)}+CN^−_{(aq)} \CH_3CH_2CO^-_{2(aq)}+HCN_{(aq)})
Gegeven: evenwichtige chemische vergelijking
Gevraagd: evenwichtspositie
Strategie:
Benoem de geconjugeerde zuur-base paren in elke reactie. Raadpleeg vervolgens de tabellen en figuur om te bepalen welk zuur en welke base het sterkst zijn. Het evenwicht is altijd in het voordeel van het zwakkere zuur-base paar.
Oplossing:
De geconjugeerde zuur-base paren zijn NH_4^+/NH_3) en HPO_4^{2-}/PO_4^{3-}). Volgens de tabellen NH_4^+ en HPO_4^{2-} is NH_4^+ een sterker zuur (pK_a = 9.25) dan HPO_4^{2-} (pKa = 12,32), en is PO_4^{3-} een sterkere base (pK_b = 1,68) dan NH_3 (pK_b = 4,75)). Het evenwicht zal daarom naar rechts liggen, ten gunste van de vorming van het zwakkere zuur-basenpaar:
De geconjugeerde zuur-basenparen zijn CH_3CH_2CO_2H/CH_3CH_2CO_2^-) en HCN/CN^-). Volgens tabel is HCN een zwak zuur (pKa = 9,21) en is CN^- een matig zwakke base (pKb = 4,79). Propionzuur (CH_3CH_2CO_2H) staat echter niet in tabel \(\PageIndex{1}). In zo’n situatie kun je het beste zoeken naar een gelijksoortige verbinding waarvan de zuur-base eigenschappen wel in de lijst staan. Bijvoorbeeld, propionzuur en azijnzuur zijn identiek behalve de groepen die aan het koolstofatoom van het carbonzuur zitten (\ce{-CH_2CH_3}} versus \ce{-CH_3}}), dus we kunnen verwachten dat de twee verbindingen vergelijkbare zuur-base eigenschappen hebben. In het bijzonder zouden we verwachten dat de waarde van propionzuur ongeveer gelijk is aan die van azijnzuur. (In feite is de pK van propionzuur 4,87, vergeleken met 4,76 voor azijnzuur, wat propionzuur een iets zwakker zuur maakt dan azijnzuur). Dus moet propionzuur een beduidend sterker zuur zijn dan HCN. Omdat het sterkere zuur de zwakkere geconjugeerde base vormt, voorspellen we dat cyanide een sterkere base zal zijn dan propionaat. Het evenwicht zal dus naar rechts liggen, ten gunste van de vorming van het zwakkere zuur-base paar:
Oefening
Voorspel of het evenwicht voor elke reactie naar links of naar rechts ligt zoals geschreven.
- (H_2O_{(l)}+HS^-_{(aq)} \rightleftharpoons OH^−_{(aq)}+H_2S_{(aq)}\)
- \(HCO^−_{2(aq)}+HSO^−_{4(aq)} \HCO_2H_{(aq)}+SO^{2-}_{4(aq)})
Antwoord a
links
Antwoord b
links
Samenvatting
Zuur-base reacties bevatten altijd twee geconjugeerde zuur-base paren. Elk zuur en elke base heeft een bijbehorende ionisatieconstante die overeenkomt met de sterkte van het zuur of de base. Twee soorten die slechts door een proton verschillen, vormen een geconjugeerd zuur-basepaar. De grootte van de evenwichtsconstante voor een ionisatiereactie kan worden gebruikt om de relatieve sterkten van zuren en basen te bepalen. Voor een waterige oplossing van een zwak zuur wordt de dissociatieconstante de zuurionisatieconstante genoemd (K_a). Op dezelfde manier is de evenwichtsconstante voor de reactie van een zwakke base met water de base-ionisatieconstante (K_b). Voor elk geconjugeerd zuur-base paar is \(K_aK_b = K_w). Kleinere waarden van (pK_a) corresponderen met grotere zuurionisatieconstanten en dus sterkere zuren. Omgekeerd corresponderen kleinere waarden van \(pK_b) met grotere base-ionisatieconstanten en dus sterkere basen. Bij 25°C is (pK_a + pK_b = 14.00). Zuur-base reacties verlopen altijd in de richting die het zwakkere zuur-base paar produceert. Geen zuur sterker dan H3O^+ en geen base sterker dan OH^- kunnen bestaan in waterige oplossing, wat leidt tot het fenomeen dat bekend staat als het nivelleringseffect. Polyprotische zuren (en basen) verliezen (en winnen) protonen op een stapsgewijze manier, waarbij de volledig geprotoneerde soort het sterkste zuur is en de volledig gedeprotoneerde soort de sterkste base.
Key vergelijkingen
- Zuur ionisatieconstante: \=dfrac{}{}
- Base ionisatie constante: = \dfrac{}{} \Verband tussen K(K_a) en K(K_b) van een geconjugeerd zuur-base paar:
- Definitie van (pK_a): \ Definitie van pK_b: \ Verband tussen de (pK_a) en (pK_b) van een geconjugeerd zuur-base paar:
Inbreng en toeschrijving
-
Stephen Lower, emeritus hoogleraar (Simon Fraser U.) Chem1 Virtueel leerboek