Entropie
Er is een tendens in de natuur voor systemen om naar een toestand van grotere wanorde of willekeur toe te werken. Entropie is een maat voor de mate van willekeur of wanorde van een systeem. Entropie is een gemakkelijk concept om te begrijpen wanneer je aan alledaagse situaties denkt. De entropie van een kamer die pas is schoongemaakt en opgeruimd is laag. Naarmate de tijd verstrijkt, zal de kamer waarschijnlijk wanordelijker worden en dus zal de entropie toenemen (zie onderstaande figuur). De natuurlijke neiging van een systeem is dat de entropie toeneemt.
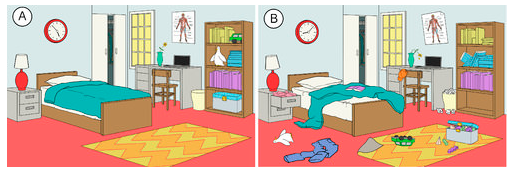
Chemische reacties hebben ook de neiging om zo te verlopen dat de totale entropie van het systeem toeneemt. Hoe kun je zien of een bepaalde reactie een toename of een afname van entropie vertoont? De moleculaire toestand van de reactanten en de producten geven bepaalde aanwijzingen. De onderstaande algemene gevallen illustreren de entropie op moleculair niveau.
- Voor een bepaalde stof is de entropie van de vloeibare toestand groter dan de entropie van de vaste toestand. Evenzo is de entropie van het gas groter dan de entropie van de vloeistof. Daarom neemt de entropie toe bij processen waarbij vaste of vloeibare reactanten gasvormige producten vormen. De entropie neemt ook toe wanneer vaste reactanten vloeibare producten vormen.
- Entropie neemt toe wanneer een stof in meerdere delen wordt opgesplitst. Het proces van oplossen verhoogt de entropie omdat de opgeloste deeltjes van elkaar gescheiden raken wanneer een oplossing wordt gevormd.
- Entropie neemt toe als de temperatuur toeneemt. Een toename van de temperatuur betekent dat de deeltjes van de stof een grotere kinetische energie hebben. De sneller bewegende deeltjes hebben meer wanorde dan deeltjes die langzamer bewegen bij een lagere temperatuur.
- Entropie neemt in het algemeen toe bij reacties waarbij het totale aantal productmoleculen groter is dan het totale aantal reactantmoleculen. Een uitzondering op deze regel is wanneer een gas wordt gevormd uit niet-gasvormige reactanten.
De onderstaande voorbeelden dienen om te illustreren hoe de entropieverandering in een reactie kan worden voorspeld.
(\ce{Cl_2} \links( g rechts) \rightarrow \ce{Cl_2}
De entropie neemt af omdat een gas een vloeistof wordt.
(\ce{CaCO_3} \links( s rechts) \rightarrow \ce{CaO} \links( s rechts) + \ce{CO_2}
De entropie neemt toe omdat er een gas wordt gevormd en het aantal moleculen toeneemt.
\links( g rechts) + 3 \ce{H_2} \links( g rechts) 2 \ce{NH_3}
De entropie neemt af omdat vier totale reactantmoleculen twee totale productmoleculen vormen. Het zijn allemaal gassen.
\links( aq rechts) + \ce{NaCl} \links( aq rrechts) \rightarrow \ce{NaNO_3} \links (aq rechts) + ÄgCl
De entropie neemt af omdat een vaste stof wordt gevormd uit waterige reactanten.
(\ce{H_2} \links( g rechts) + \ce{Cl_2} \links( g rechts) pijl 2 HCl
De entropieverandering is onbekend (maar waarschijnlijk niet nul), want er zijn evenveel moleculen aan beide kanten van de vergelijking en ze zijn allemaal gassen.