Het Atoommodel
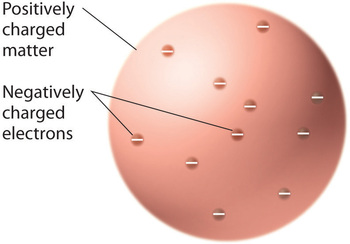
Toen wetenschappers tot de conclusie kwamen dat alle materie negatief geladen elektronen bevat, werd het duidelijk dat atomen, die elektrisch neutraal zijn, ook positieve ladingen moeten bevatten om de negatieve te compenseren. Thomson stelde voor dat de elektronen waren ingebed in een uniforme bol die zowel de positieve lading als het grootste deel van de massa van het atoom bevatte, ongeveer zoals rozijnen in pruimenpudding of chocoladesnippers in een koekje (figuur.)
2.4.6
Figuur figuur: Thomson’s Plum Pudding of Chocolate Chip Cookie model van het atoom. In dit model zijn de elektronen ingebed in een uniforme bol van positieve lading. Afbeelding gebruikt met toestemming (CC BY-SA-NC).
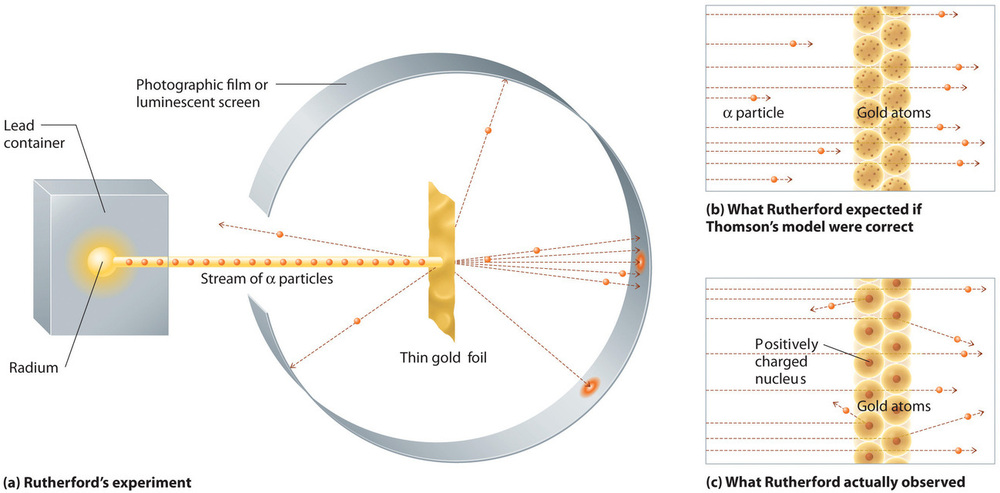
In één beroemd experiment toonde Rutherford echter ondubbelzinnig aan dat Thomson’s model van het atoom onjuist was. Rutherford richtte een stroom α-deeltjes op een zeer dun object van goudfolie (figuur) en onderzocht hoe de α-deeltjes door de folie werden verstrooid. Goud werd gekozen omdat het gemakkelijk in uiterst dunne platen kon worden gehamerd, waardoor het aantal atomen in het doel tot een minimum kon worden beperkt. Als Thomsons atoommodel juist was, zouden de positief geladen α-deeltjes door de gelijkmatig verdeelde massa van het gouden doelwit moeten knallen als kanonskogels door de zijkant van een houten huis. Tot Rutherfords verbazing werd een klein deel van de α-deeltjes onder een grote hoek afgebogen, en sommige werden direct naar de bron teruggekaatst (figuur). Volgens Rutherford “was het bijna net zo ongelooflijk als wanneer je een granaat van 15 inch op een stuk vloeipapier afvuurt en het komt terug en raakt je.”
2.4.7
Figuurtje: Een samenvatting van Rutherford’s experimenten. (a) Een afbeelding van het apparaat dat Rutherford gebruikte om afbuigingen te detecteren in een stroom van α-deeltjes gericht op een dun doelwit van goudfolie. De deeltjes werden geproduceerd door een monster van radium. (b) Als Thomsons model van het atoom juist was, zouden de α-deeltjes dwars door de goudfolie heen moeten zijn gegaan. (c) Een klein aantal α-deeltjes werd echter afgebogen in verschillende richtingen, waaronder recht terug naar de bron. Dit kon alleen waar zijn als de positieve lading veel massiever was dan het α-deeltje. Het suggereerde dat de massa van het goudatoom geconcentreerd is in een zeer klein gebied van de ruimte, dat hij de kern noemde. Image used with Permission (CC BY-SA-NC).
Rutherfords resultaten waren niet consistent met een model waarin de massa en de positieve lading gelijkmatig over het volume van een atoom zijn verdeeld. In plaats daarvan suggereerden zij sterk dat zowel de massa als de positieve lading geconcentreerd zijn in een klein deel van het volume van een atoom, dat Rutherford de kern noemde. Het was logisch dat een klein deel van de α-deeltjes tegen de dichte, positief geladen kernen botsten, hetzij in een schampschot, resulterend in grote afbuigingen, of bijna frontaal, waardoor zij recht naar de bron werden teruggekaatst.
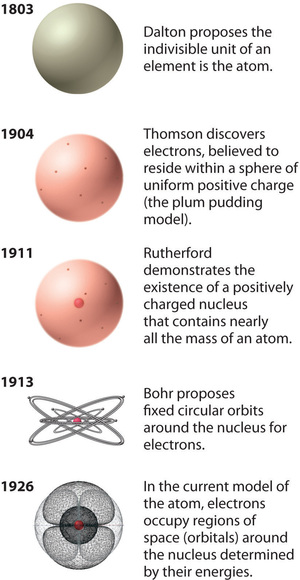
Hoewel Rutherford niet kon verklaren waarom afstotingen tussen de positieve ladingen in kernen die meer dan één positieve lading bevatten, niet tot gevolg hadden dat de kern uiteenviel, redeneerde hij dat afstotingen tussen negatief geladen elektronen ertoe zouden leiden dat de elektronen uniform verdeeld zouden worden over het volume van het atoom.Tegenwoordig is bekend dat sterke kernkrachten, die veel sterker zijn dan elektrostatische interacties, de protonen en de neutronen bijeenhouden in de kern. Voor deze en andere inzichten kreeg Rutherford in 1908 de Nobelprijs voor scheikunde. Helaas had Rutherford liever de Nobelprijs voor Natuurkunde gekregen, omdat hij natuurkunde superieur achtte aan scheikunde. Naar zijn mening is alle wetenschap ofwel natuurkunde ofwel postzegels verzamelen: Een overzicht van de historische ontwikkeling van modellen van de componenten en de structuur van het atoom. De data tussen haakjes zijn de jaren waarin de belangrijkste experimenten werden uitgevoerd. Afbeelding gebruikt met toestemming (CC BY-SA-NC).
De historische ontwikkeling van de verschillende modellen van de structuur van het atoom is samengevat in (Figuur) Rutherford stelde vast dat de kern van het waterstofatoom een positief geladen deeltje was, waarvoor hij in 1920 de naam proton bedacht. Hij suggereerde ook dat de kernen van andere elementen dan waterstof elektrisch neutrale deeltjes moeten bevatten met ongeveer dezelfde massa als het proton. Het neutron werd echter pas in 1932 ontdekt, toen James Chadwick (1891-1974, een leerling van Rutherford; Nobelprijs voor de Natuurkunde, 1935) het ontdekte. Als gevolg van Rutherfords werk werd duidelijk dat een α-deeltje twee protonen en neutronen bevat, en dus de kern is van een heliumatoom.
2.4.9
Figuurtje (Pagina-index{12}): De evolutie van de atoomtheorie, zoals geïllustreerd door modellen van het zuurstofatoom. Het model van Bohr en het huidige model worden beschreven in hoofdstuk 6, “De structuur van atomen.” Afbeelding gebruikt met toestemming (CC BY-SA-NC).
Rutherford’s model van het atoom is in essentie hetzelfde als het moderne model, behalve dat nu bekend is dat elektronen niet gelijkmatig verdeeld zijn over het volume van een atoom. In plaats daarvan zijn ze verdeeld volgens een aantal principes die door de Quantum Mechanica worden beschreven. Figuur laat zien hoe het atoommodel zich in de loop van de tijd heeft ontwikkeld van de ondeelbare eenheid van Dalton tot het moderne beeld dat tegenwoordig wordt onderwezen.