Autoimmuun hemolytische anemie (AIHA) wordt gemedieerd door antilichamen, en in de meeste gevallen is immunoglobuline (Ig) G het mediërende antilichaam. Dit type AIHA wordt “warme” AIHA genoemd omdat IgG-antilichamen zich het best binden bij lichaamstemperatuur. “Koude” AIHA wordt gemedieerd door IgM-antilichamen, die maximaal binden bij temperaturen onder 37°C. AIHA veroorzaakt door een geneesmiddelreactie is zeldzaam, met een geschatte jaarlijkse incidentie van 1:1.000.000 voor ernstige geneesmiddel-gerelateerde AIHA.1 Dit artikel bespreekt de behandeling van de meest voorkomende vormen van AIHA, met de nadruk op warme, koude en geneesmiddel-geïnduceerde AIHA; de evaluatie en diagnose van AIHA wordt in een afzonderlijk artikel besproken.
Warme autoimmuun hemolytische anemie
Bij AIHA wordt de hemolyse gemedieerd door antistoffen die zich binden aan het oppervlak van rode bloedcellen. AIHA waarbij IgG-antilichamen de beledigende antilichamen zijn, wordt warme AIHA genoemd. “Warm” verwijst naar het feit dat de antistof zich het best bindt bij lichaamstemperatuur (37°C). Bij warme AIHA zal bij het testen blijken dat IgG-moleculen aan het oppervlak van de rode cellen zijn gehecht, waarbij bij 50% van de patiënten ook C3 wordt aangetoond. Tussen 50% en 90% van de AIHA gevallen zijn te wijten aan warme antilichamen.2,3 De incidentie van warme AIHA varieert per reeks, maar is ongeveer 1 geval per 100.000 patiënten per jaar; deze vorm van hemolyse treft vaker vrouwen dan mannen.4,5
Therapeutische opties
Eerste lijn
Steroïden. Het doel van de therapie bij warme AIHA kan moeilijk te definiëren zijn. De meesten zullen het er echter over eens zijn dat een hematocriet van meer dan 30% (of hoger om symptomen te voorkomen) met een minimale toename van het aantal reticulocyten – wat wijst op een aanzienlijk vertraagd hemolytisch proces – een redelijk doel is. De initiële behandeling van warme AIHA is prednison in een standaarddosis van 1 mg/kg per dag (tabel 1).6,7 Patiënten moeten ook worden gestart met protonpompremmers om ulcera te voorkomen. Het kan tot 3 weken duren voordat patiënten reageren op prednisontherapie. Zodra het hematocriet van de patiënt boven 30% is, wordt de prednison langzaam afgebouwd. Hoewel ongeveer 80% van de patiënten op steroïden reageert, kan slechts 30% volledig van de steroïden worden afgebouwd. Voor patiënten die een dagelijkse dosis steroïden van 10 mg of minder kunnen volhouden, kunnen steroïden de meest redelijke langetermijnbehandeling zijn. Omdat actieve hemolyse leidt tot een verhoogde behoefte aan foliumzuur, krijgen patiënten met warme AIHA bovendien vaak 1 mg foliumzuur per dag voorgeschreven om megaloblastaire anemie als gevolg van foliumzuurtekort te voorkomen.
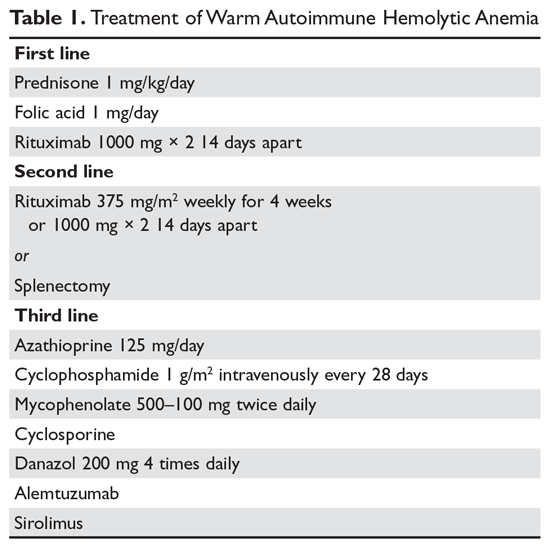
Rituximab. In toenemende mate wordt rituximab (anti-CD20) toegevoegd aan de steroïden. Twee klinische studies toonden zowel een verhoogde respons op lange als korte termijn aan bij gebruik van rituximab.8,9 Een belangrijke overweging is dat de meeste patiënten in de loop van weken geleidelijk op rituximab reageren, zodat een snelle respons niet moet worden verwacht. De meeste studies hebben de traditionele dosering van 375 mg/m2 per week gedurende 4 weken gebruikt. Deze respons lijkt duurzaam te zijn, maar net als bij immuun trombocytopenie (ITP) is herhaalde behandeling met rituximab effectief.
De belangrijkste bijwerkingen van rituximab zijn infusiereacties, die vaak erger zijn bij de eerste dosis. Deze reacties kunnen onder controle worden gehouden met antihistaminica, steroïden en, bij ernstige rigor, meperidine. In zeldzame gevallen kunnen patiënten neutropenie ontwikkelen (ongeveer 1:500) die auto-immuun van aard lijkt te zijn. Infecties lijken slechts minimaal toe te nemen bij gebruik van rituximab.10 Een risicogroep zijn chronische dragers van het hepatitis B-virus, bij wie een reactivatie van het virus kan optreden die fataal kan zijn. Daarom moeten patiënten die in aanmerking komen voor rituximab worden gescreend op dragerschap van het hepatitis B-virus.11 Patiënten die rituximab krijgen, lopen een zeer gering risico op progressieve multifocale leuko-encefalopathie, die vaker voorkomt bij patiënten met kanker en bij zwaar immuno-onderdrukte patiënten. Het totale risico is onbekend, maar is minder dan 1:50.000.