Het chemische element helium wordt geclassificeerd als een edelgas en een niet-metaal. Het werd in 1895 ontdekt door William Ramsay.

Data Zone
| Classificatie: | Helium is een edelgas en een niet-metaal |
| Kleur: | kleurloos |
| Atomisch gewicht: | 4.00260 |
| Staat: | gas |
| Smeltpunt: | -272,2 oC, 0,95 K |
| Noot: Bij normale atmosferische druk stolt helium niet en heeft het dus geen smeltpunt. Het hierboven genoemde smeltpunt geldt bij een druk van 25 atmosfeer. | |
| kookpunt: | -268,9 oC, 4.2 K |
| Elektronen: | 2 |
| Protonen: | 2 |
| Neutronen in meest voorkomende isotoop: | 2 |
| Elektronenschillen: | 2 |
| Elektronenconfiguratie: | 1s2 |
| Dichtheid bij 20oC: | 0.0001787 g/cm3 |
Toon meer, o.a.: Warmte, Energieën, Oxidatie,
Reacties, Verbindingen, Stralen, Geleidbaarheden
| Atomair volume: | 27,2 cm3/mol |
| Structuur: | meestal hexagonaal dicht opeengepakt |
| (v.hoge druk nodig om helium te stollen) | |
| Specifieke warmtecapaciteit | 5,193 J g-1 K-1 |
| Fusiehitte | 0.0138 kJ mol-1 |
| Warmte bij atomisatie | 0 |
| Warmte bij verdamping | 0.0845 kJ mol-1 |
| 1e ionisatie-energie | 2372.3 kJ mol-1 |
| 2e ionisatie-energie | – |
| 3e ionisatie-energie | – |
| Elektronenaffiniteit | 0 kJ mol-1 |
| Minimum oxidatiegetal | 0 |
| Min. gemeenschappelijk oxidatiegetal | 0 |
| Maximaal oxidatiegetal | 0 |
| Max. gemeenschappelijk oxidatiegetal | 0 |
| Maximum. | 0 |
| Elektronegativiteit (Pauling Schaal) | – |
| Polariseerbaarheidsvolume | 0.198 Å3 |
| Reactie met lucht | geen |
| Reactie met 15 M HNO3 | geen |
| Reactie met 6 M HCl | geen |
| Reactie met 6 M NaOH | geen |
| Oxide(n) | geen |
| Hydride(n) | geen |
| Chloride(s) | geen |
| Atomaire radius | 31 pm |
| Ionische radius (1+ ion) | – |
| Ionstraal (2+ ion) | – |
| Ionstraal (3+ ion) | – |
| Ionstraal (1- ion) | – |
| ionstraal (2-ion) | – |
| ionstraal (3-ion) | – |
| warmtegeleidingscoëfficiënt | 0.15 W m-1 K-1 |
| Elektrisch geleidingsvermogen | – |
| Vries-/Smeltpunt: | -272,2 oC, 0.95 K |

Nasa: Geïoniseerde heliumatomen bij ongeveer 60.000 °C in de chromosfeer van de zon zenden het ultraviolette licht uit dat op deze afbeelding te zien is.
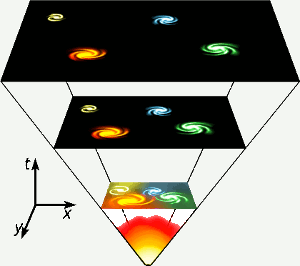
Helium werd gemaakt in de eerste drie minuten van het bestaan van het heelal, toen de temperaturen overal hoog genoeg waren om kernfusie te laten plaatsvinden. Deze korte, hoogenergetische fase wordt helemaal onderaan in het diagram weergegeven. Helium wordt ook gemaakt door kernfusie van waterstof in sterren zoals de onze. Afbeelding: Gnixon
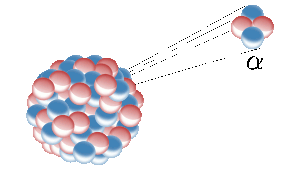
Helium op aarde komt van kernsplitsing van radioactieve elementen zoals uranium. Hier zendt een radioactieve kern een heliumkern uit (ook bekend als een alfadeeltje). Beeld: Inductiveload

Heliumspectrum met prominente gele lijn. Beeld: Nasa

William Ramsay wijst naar de laatste kolom van het periodiek systeem met de edele (of inerte) gassen. Ramsay kreeg de Nobelprijs voor scheikunde in 1904 voor zijn werk bij de ontdekking van de inerte gassen. Afbeelding: Vanity Fair
Ontdekking van Helium
Het verhaal van de ontdekking van helium is verweven met de ontdekking van de aard van sterren.
Ooit geloofde men dat we nooit zouden weten waar sterren van gemaakt zijn. In 1835 verklaarde de Franse filosoof Auguste Comte: “Wij zullen nooit in staat zijn op enigerlei wijze hun chemische samenstelling te bestuderen.” (1)
Comte dacht dat we alleen te weten konden komen wat sterrenmateriaal was als we het in het laboratorium konden krijgen.
Ondanks Comte’s pessimisme was de methode voor de ontdekking van helium en de samenstellingen van de sterren al gevonden. In 1814 had de Duitse natuurkundige Joseph Fraunhofer de methode van Isaac Newton om het zonlicht te splitsen met behulp van een prisma overgenomen en een cruciale vooruitgang geboekt. Fraunhofer had donkere lijnen opgemerkt in de regenboog van kleuren die afkomstig waren van zonlicht dat door een prisma was gesplitst; de lijnen die hij zag waren de allereerste waarnemingen van het spectrum van een ster. (2), (3)
In 1859/60 maakten de Duitse wetenschappers Gustav Kirchhoff en Robert Bunsen enorme sprongen in de wetenschap van de spectroscopie, waaronder de ontdekking dat de donkere lijnen die Fraunhofer had gezien, te vergelijken waren met de vingerafdruk van een stof.
De weg was vrij voor Kirchhoff en Bunsen om nieuwe elementen te ontdekken door het licht van brandende stoffen te bestuderen.
In 1860 ontdekten zij cesium aan de hand van de blauwe spectraallijnen en in 1861 rubidium aan de hand van twee rode spectraallijnen. Vervolgens ontdekte William Crookes in 1861 thallium na het waarnemen van een heldere groene spectraallijn.
Kirchhoff en Bunsen keken naar het spectrum van de zon en konden concluderen dat ijzer aanwezig was in haar gloeiende atmosfeer. (4)
Voor de ontdekking van helium waren nog een paar jaar nodig. In augustus 1868 zou de eerste totale eclips plaatsvinden sinds het werk van Kirchhoff en Bunsen was gepubliceerd.
De Franse astronoom Pierre Janssen wachtte op een eclips om protuberansen in de corona van de zon te kunnen waarnemen met behulp van een spectroscoop. In de twee weken na de eclips ontwikkelde Janssen een methode om de spectra van protuberansen vast te leggen zonder dat daarvoor een eclips nodig was. In deze spectra nam hij een gele lijn waar. (5)
De lijn bevond zich op een soortgelijke maar niet identieke plaats als lijnen in het spectrum van natrium. Deze werden de D1 en D2 lijnen genoemd. De Engelse wetenschapper Norman Lockyer bestudeerde de nieuwe gele lijn; later zou deze de D3 lijn worden genoemd. Hij publiceerde zijn studie van de lijn, in het besef dat deze veroorzaakt zou kunnen worden door een nieuw element:
“…dus toen wisten we dat we niet te maken hadden met waterstof; vandaar dat we te maken hadden met een element dat we niet in onze laboratoria konden krijgen, en daarom nam ik de verantwoordelijkheid op mij om het woord helium te bedenken, in eerste instantie voor laboratoriumgebruik.” (6)
De naam helium kwam van het Griekse woord voor de zon, helios.
Lockyer en Edward Frankland, zijn medewerker, hadden een aantal andere ideeën over de mogelijke oorzaken van de gele lijn en kondigden daarom geen nieuw element aan.
Tegen 1871 waren andere wetenschappers op de hoogte van de situatie. Lord Kelvin besprak de “weerkaatsing van het licht van de gloeiende waterstof en ‘helium’ rond de zon.” Het gebruik van ‘helium’ wordt gevolgd door een voetnoot om het uit te leggen:
“Frankland en Lockyer vinden dat de gele protuberansen een zeer besliste heldere lijn geven niet ver van D, maar tot nu toe niet geïdentificeerd met enige aardse vlam. Het lijkt te wijzen op een nieuwe substantie, die zij Helium willen noemen.” (7)
Het bestaan van Helium werd echter niet door iedereen aanvaard. (5)
Alle twijfels werden weggenomen toen de Schotse scheikundige William Ramsay in 1895 in Londen helium isoleerde. Ramsay had in 1894 argon mede-ontdekt; argon was het eerste van de edelgassen dat werd ontdekt. In 1895 las hij een artikel van William Hillebrand waarin een onreactief gas werd beschreven dat vrijkwam wanneer zuur werd toegevoegd aan het uraniummineraal uraniet. Hillebrand dacht dat het gas stikstof was.
Ramsay, die dacht dat het gas argon kon zijn, herhaalde Hillebrand’s experiment met een ander uraniummineraal, cleveiet, en verzamelde het gas.
Zijn spectroscoop toonde de aanwezigheid aan van stikstof, argon en een ander gas. Ramsay vermoedde dat het helium kon zijn, omdat er een D3-lijn leek te zijn. (8) Omdat hij wist dat Lockyer en William Crookes een betere spectroscoop hadden dan de zijne, stuurde hij hen een monster van het gas. Helaas was het monster niet geschikt, dus haalde Lockyer een monster van uraniet, extraheerde het gas en bestudeerde het met de spectroscoop. Hij schrijft: (8)
“Een voor een bleken de onbekende lijnen die ik in 1868 bij de zon had waargenomen, tot het gas te behoren.”
Het spectrum van het gas was identiek aan het ‘helium’ van de zon. Een nieuw element veroverde zijn plaats in het periodiek systeem.
Bezoek de pagina met coole heliumfeiten van Chemicool.

Uiterlijk en Eigenschappen
Schadelijke effecten:
Van helium is niet bekend dat het giftig is.
Eigenschappen:
Helium is een licht, reukloos, kleurloos, inert, monoatomair gas. Het kan diatome moleculen vormen, maar slechts in geringe mate en bij temperaturen dicht bij het absolute nulpunt.
Helium heeft het laagste smeltpunt van alle elementen en zijn kookpunt ligt dicht bij het absolute nulpunt.
In tegenstelling tot alle andere elementen wordt helium niet hard, maar blijft het onder normale druk vloeibaar tot het absolute nulpunt (0 K).
De stem van iemand die helium heeft ingeademd, klinkt tijdelijk hoog.
Toepassingen van helium
Magnetic resonance imaging (MRI) is de grootste gebruiker van helium. Het helium wordt gebruikt om de supergeleidende magneten van MRI-scanners te koelen.
Helium wordt gebruikt voor het vullen van ballonnen (blimps) en voor het onder druk brengen van raketten met vloeibare brandstof.
Mengsels van helium en zuurstof worden gebruikt als kunstmatige ‘lucht’ voor duikers en anderen die onder druk werken. Helium wordt gebruikt in plaats van de stikstof in gewone lucht, omdat helium na een lange duik het lichaam sneller verlaat dan stikstof, waardoor een snellere decompressie mogelijk is.
Helium wordt gebruikt als een gasschild in de nabijheid van booglassen, waardoor bijvoorbeeld elke reactie van hete metalen lassen met zuurstof wordt voorkomen. Het gas wordt gebruikt in de halfgeleiderindustrie om een inerte atmosfeer te verschaffen voor het groeien van silicium- en germaniumkristallen. Het wordt ook gebruikt als hogetemperatuurgas bij de productie van titanium en zirkonium, en als draaggas bij gaschromatografie.
Bundantie en isotopen
Bundantie aardkorst: 8 delen per miljard in gewicht, 43 delen per miljard in mol
Overvloed zonnestelsel: 23 % in gewicht, 7,4 % in mol
Kosten, zuiver: $ 5,2 per 100g
Kosten, bulk: $ per 100g
Bron: Bijna al het helium op aarde is het resultaat van radioactief verval. De belangrijkste bronnen van helium komen uit aardgasvoorraden in putten in Texas, Oklahoma en Kansas. Helium wordt gewonnen door gefractioneerde destillatie van het aardgas, dat tot 7% helium bevat.
Isotopen: Helium heeft 8 isotopen waarvan de halveringstijd bekend is, met massanummers 3 tot 10. Natuurlijk voorkomend helium is een mengsel van zijn twee stabiele isotopen, 3He en 4He met natuurlijke abundanties van respectievelijk 0,0001% en 99,999%.

- Auguste Comte, Cours de Philosophie Positive at Project Gutenberg
- Keith J. Laidler, The World of Physical Chemistry, 1993, p179.
- The Era of Classical Spectroscopy, van MIT Spectroscopy.
- Gerard G. Emch, Mathematical and Conceptual Foundations of 20th-Century Physics., 1984, Elsevier Science Publishers, p211
- Helge Kragh, The Solar Element: A Reconsideration of Helium’s Early History., 2009, Annals of Science, 66:2, p157-182.
- J. Norman Lockyer, The Growth of our Knowledge of Helium., Science Progress, 1896, Vol 5., p249
- W. Thomson, Presidential Address, British Association for the Advancement of Science, 1871, (Address. XCIX).
- Sir Norman Lockyer, The Sun’s Place in Nature., 1897, p47-48
Citeer deze pagina
Voor online-linking, kopieer en plak een van de volgende:
<a href="https://www.chemicool.com/elements/helium.html">Helium</a>
of
<a href="https://www.chemicool.com/elements/helium.html">Helium Element Facts</a>
Om deze pagina in een academisch document te citeren, gebruik de volgende MLA-conforme citatie:
"Helium." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/helium.html>.