In de chemie beschrijft de T-vormige moleculaire geometrie de structuren van sommige moleculen waarin een centraal atoom drie liganden heeft. Gewoonlijk hebben drie-gecoördineerde verbindingen een trigonale vlakke of piramidale geometrie. Voorbeelden van T-vormige moleculen zijn de halogeentrifluoriden, zoals ClF3.
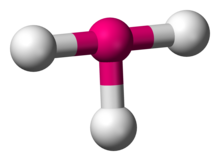
ClF3
C2v
90°, 180°
>0

Volgens de VSEPR-theorie ontstaat een T-vormige geometrie wanneer drie liganden en twee eenzame elektronenparen aan het centrale atoom zijn gebonden, in AXE-notatie geschreven als AX3E2. De T-vormige geometrie is verwant aan de trigonale bipyramidale geometrie voor AX5-moleculen met drie equatoriale en twee axiale liganden. In een AX3E2-molecuul bezetten de twee lone paren twee equatoriale posities, en de drie ligandatomen bezetten zowel de twee axiale posities als één equatoriale positie. De drie atomen binden onder een hoek van 90° aan één kant van het centrale atoom, waardoor de T-vorm ontstaat.
Het trifluoroxenaat(II) anion, XeF-
3, is onderzocht als mogelijk eerste voorbeeld van een AX3E3 molecuul, waarvan op grond van VSEPR redenering verwacht zou kunnen worden dat het zes elektronenparen in een octahedrale opstelling heeft met zowel de drie lone paren als de drie liganden in een mer- of T-vormige oriëntatie. Hoewel dit anion in de gasfase is gedetecteerd, waren pogingen tot synthese in oplossing en experimentele structuurbepaling niet succesvol. Een computationeel-chemische studie toonde een vervormde planaire Y-vormige geometrie met de kleinste F-Xe-F bindingshoek gelijk aan 69°, in plaats van 90° zoals in een T-vormige geometrie.