De termen; luminescentie, fotoluminescentie, fluorescentie en fosforescentie worden routinematig gebruikt in onderzoekspapers om de emissie van licht van een monster te beschrijven. Deze meervoudige naamgeving kan verwarrend zijn omdat verschillende termen door elkaar worden gebruikt en onderzoekers met verschillende wetenschappelijke achtergronden de voorkeur geven aan de ene naam boven de andere. In dit artikel beantwoorden we de vraag: “Wat is het verschil tussen luminescentie, fotoluminescentie, fluorescentie en fosforescentie?”
Wat is luminescentie?
Luminescentie is elke emissie van licht (elektromagnetische golven) door een stof die niet het gevolg is van verhitting. Deze definitie onderscheidt luminescentie van gloeien, wat lichtemissie is ten gevolge van de verhoogde temperatuur van een stof, zoals een gloeiend hete sintel. Het woord luminescentie is afgeleid van het Latijnse woord voor licht, lumen, en het Latijnse escentia, dat “het proces van” betekent, en is dus het proces van het afgeven van licht.

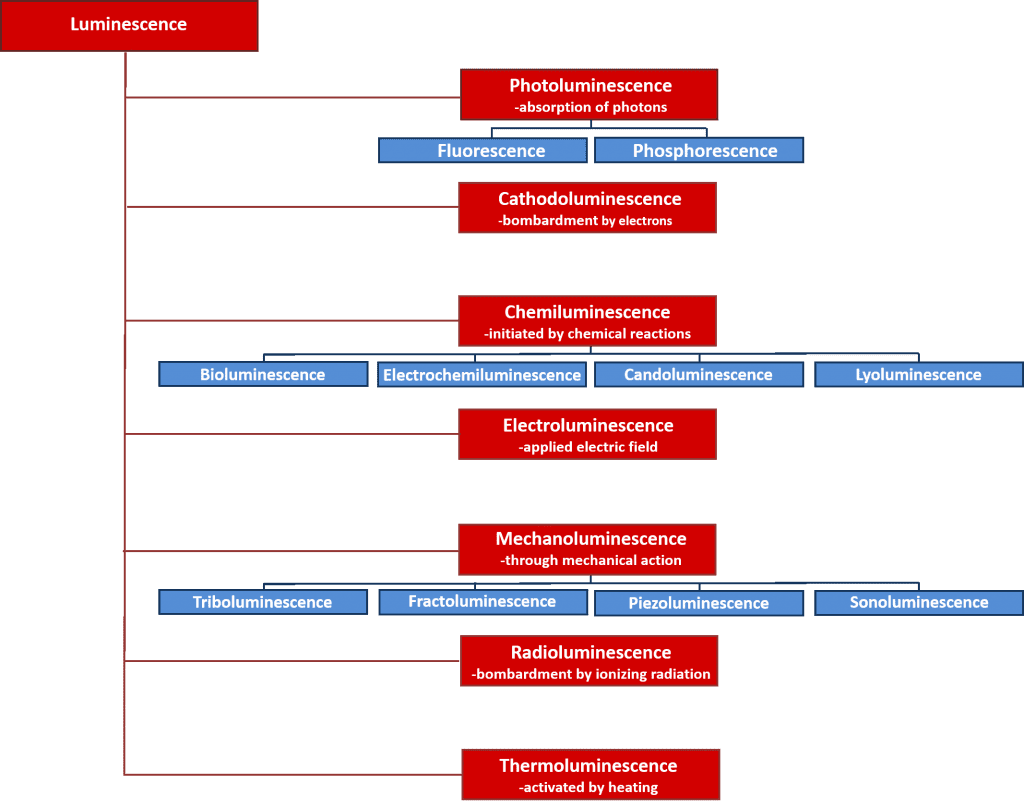
Er zijn vele soorten luminescentie die kunnen worden ingedeeld naar de energiebron die het luminescentieproces in gang zet. Een overzicht van de verschillende soorten luminescentie en hun energiebronnen is gegeven in figuur 2. Veel van deze luminescentieprocessen hebben belangrijke wetenschappelijke en industriële toepassingen, zoals elektroluminescentie, waarbij licht wordt uitgezonden door de recombinatie van elektronen en gaten nadat een elektrisch veld over een materiaal is aangelegd, en die het werkingsprincipe vormt achter lichtgevende dioden; en chemiluminescentie, waarbij de lichtemissie wordt geïnitieerd door een chemische reactie en wordt gebruikt in biologische tests en verantwoordelijk is voor het gloeien van gloeistaven. In dit artikel ligt de nadruk echter op fotoluminescentie, die de basis vormt van de krachtige niet-destructieve spectroscopische techniek, fotoluminescentiespectroscopie, die zowel in de academische wereld als in het bedrijfsleven op grote schaal wordt gebruikt.
Wat is fotoluminescentie?
Fotoluminescentie is de emissie van licht uit een materiaal na de absorptie van licht. Het woord op zich is interessant omdat het de combinatie is van het uit het Latijn afgeleide woord luminescentie en het Griekse voorvoegsel, foto-, voor licht. Elke luminescentie die wordt geïnduceerd door de absorptie van fotonen wordt fotoluminescentie genoemd. Dit kan zowel lichtemissie van een organisch kleurstofmolecuul in oplossing zijn (figuur 3a), als band-tot-band recombinatie van elektronen en gaten na foto-oxcitatie van een halfgeleider (figuur 3b).

Het omschrijven van elke door fotonabsorptie geïnduceerde lichtemissie als fotoluminescentie is accuraat; het is echter gebruikelijk, vooral door chemici, om fotoluminescentie verder onder te verdelen in fluorescentie en fosforescentie.
Wat is het verschil tussen fluorescentie en fosforescentie?
Er zijn verschillende definities van fluorescentie en fosforescentie, waarbij de eenvoudigste is dat fluorescentie een snelle fotoluminescentie is die zeer kort na de fotoexcitatie van een stof optreedt, terwijl fosforescentie een fotoluminescentie is met een lange levensduur die nog lang na de fotoexcitatie voortduurt. Hoewel dit een eenvoudige definitie is, verklaart zij niet waarom zo’n verschil in de tijdschalen van de fotoluminescentie optreedt en sommige materialen kunnen in een grijs gebied vallen tussen de klassieke fluorescentie- en fosforescentietijdschalen. Een grondigere definitie moet worden gebaseerd op de kwantummechanica van aangeslagen en grondtoestanden die bij het emissieproces betrokken zijn. Met deze benadering kunnen fluorescentie en fosforescentie worden gedefinieerd als respectievelijk fotoluminescentie waarbij voor de radiatieve overgang geen verandering in spinmultipliciteit nodig is en fotoluminescentie waarbij voor de radiatieve overgang wel een verandering in spinmultipliciteit nodig is.
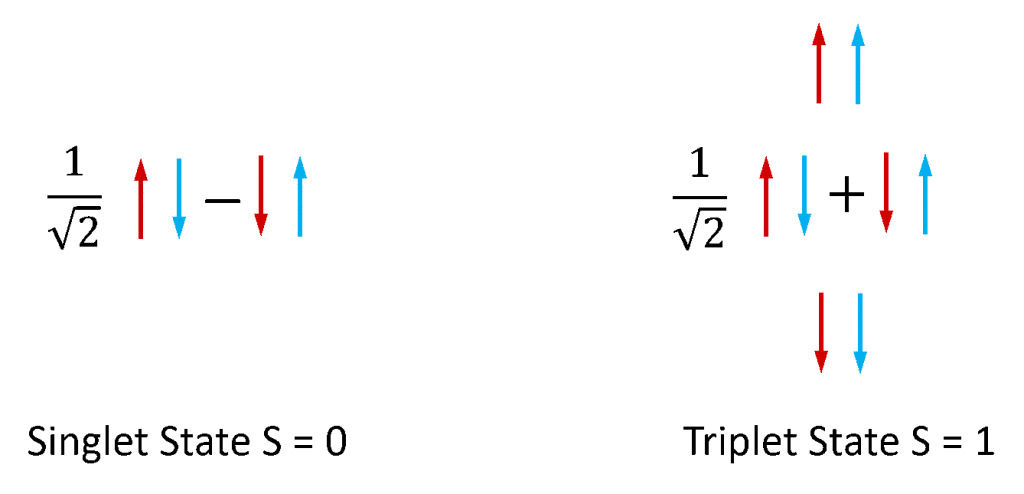
Fluorescentie en fosforescentie worden meestal gebruikt om te verwijzen naar fotoluminescentie van moleculaire systemen. Elektronen in stabiele moleculen bestaan altijd in paren, aangezien moleculen met ongepaarde elektronen uiterst reactief en onstabiel zijn. Elektronen bezitten een intrinsiek impulsmoment dat “spin” wordt genoemd en een elektronenpaar kan bestaan in een van de twee totale spin-toestanden, afhankelijk van de relatieve symmetrie van de spins van de twee elektronen. Als de twee spins zich in een antisymmetrische configuratie bevinden, heeft het elektronenpaar een totale spin van nul (S = 0), terwijl als zij zich in een symmetrische configuratie bevinden, het paar een totale spin van één heeft (S = 1). Zoals geïllustreerd in figuur 4 is er één combinatie van elektronspintoestanden die antisymmetrisch is en drie combinaties van spintoestanden die symmetrisch zijn. De toestanden S = 0 en S = 1 worden daarom respectievelijk de singlet- en triplettoestanden genoemd.
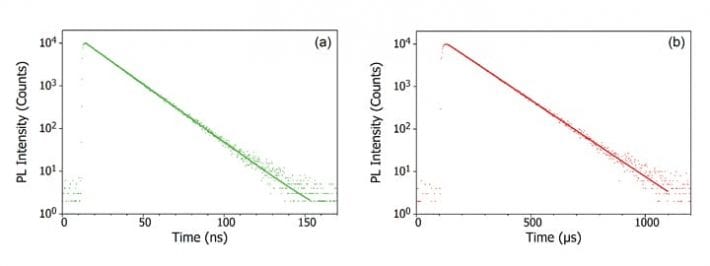
Wanneer een foton door het molecuul wordt geabsorbeerd, wordt een van de elektronen naar een hoger energieniveau gepromoveerd en bevindt het molecuul zich nu in een aangeslagen toestand. De grondtoestand van een molecuul is (bijna) altijd een singlettoestand (S0) en door behoud van impulsmoment moet de aangeslagen toestand ook een singlettoestand (S1) zijn, zoals te zien is in het Jablonski-diagram hieronder. Het verval van de S1-toestand terug naar de S0-toestand is een toegestane overgang (aangezien beide toestanden dezelfde spin-multipliciteit hebben) die resulteert in een snelle fotoluminescentie die optreedt in de tijdschaal van picoseconden tot nanoseconden en fluorescentie wordt genoemd.
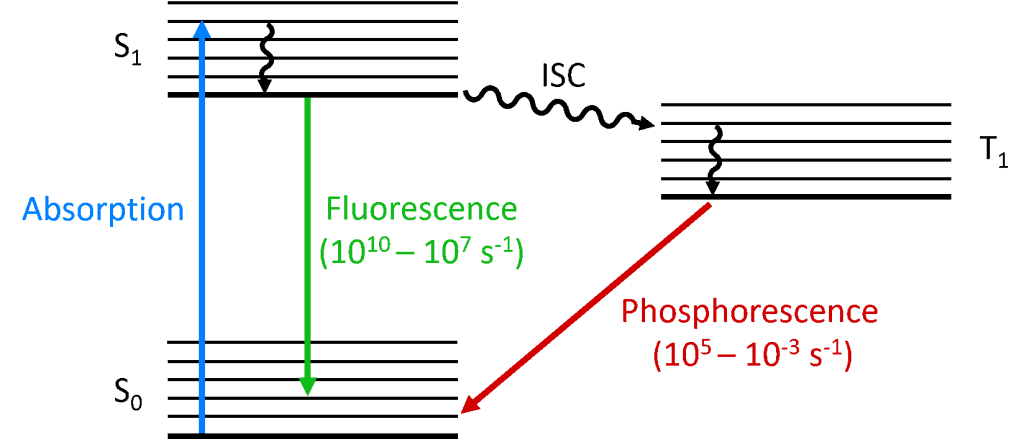
Een andere mogelijkheid is dat het molecuul een intersysteemovergang (ISC) ondergaat naar de aangeslagen triplet toestand (T1). ISC treedt meestal op in moleculen met een hoge mate van spin-orbitkoppeling, de koppeling van het baanhoekmomentum en het spinhoekmomentum van het elektron, die conversie tussen de singlet- en triplettoestand mogelijk maakt. De spin-orbit-koppelingskracht neemt toe met de massa van het atoom, en daarom moeten fosforescerende moleculen zware metalen bevatten, zoals europium en iridium. Het verval van de T1 toestand terug naar de S0 is een verboden overgang omdat de toestanden een verschillende spin multipliciteit hebben, als gevolg van het behoud van het impulsmoment. Door spin-baankoppeling wordt deze beperking echter versoepeld en wordt een radiatieve overgang van de T1 naar de S1 mogelijk. Aangezien deze “verboden” is, treedt de fotoluminescentie die het gevolg is van de T1 naar S0 overgang op een veel tragere tijdschaal op, microseconden tot duizenden seconden, en wordt fosforescentie genoemd.
Ook dient te worden opgemerkt dat de emissie van sommige materialen niet altijd netjes in de ene of de andere categorie valt. Een voorbeeld hiervan is thermisch geactiveerde vertraagde fluorescentie (TADF). Bij TADF liggen de S1- en T1-niveaus dicht bij elkaar in energie en zijn ze sterk gekoppeld, zodat omgekeerde ISC van de T1 naar de S1 mogelijk is. Dit geeft aanleiding tot een vertraagde S1 naar S0 overgang die resulteert in fotoluminescentie op een tijdschaal tussen fluorescentie en fosforescentie, bekend als vertraagde fluorescentie. Lees voor meer informatie over TADF en het gebruik ervan in OLED’s met een hoog rendement het bericht ‘Wat is TADF?’.
Wanneer emissie wordt beschreven als fotoluminescentie versus fluorescentie/fosforescentie is uiteindelijk een kwestie van persoonlijke voorkeur. Chemici en biologen, die hoofdzakelijk moleculaire systemen bestuderen, geven de voorkeur aan het gebruik van fluorescentie en fosforescentie omdat er in deze sterk gelokaliseerde moleculaire systemen verschillende singlet- en triplettoestanden zijn. Fysici daarentegen bestuderen voornamelijk halfgeleidende materialen waar de elektronen sterk gedelokaliseerd zijn en het concept van singlet en triplet vaak niet meer relevant is. Dit is een van de redenen waarom natuurkundigen de bredere term fotoluminescentie gebruiken om lichtemissie te beschrijven.
Hoe je het ook wilt noemen; fotoluminescentie, fluorescentie en fosforescentie kunnen een schat aan informatie opleveren over de eigenschappen van moleculen en materialen; variërend van het bepalen van de levensduur van ladingsdragers in zonnecellen tot het meten van de solvatiedynamiek rond micellen in levende cellen.
Producten voor luminescentie, fotoluminescentie, fluorescentie en fosforescentie
Om fotoluminescentie te meten is een fotoluminescentie spectrometer nodig en Edinburgh Instruments biedt een reeks fotoluminescentie spectrometers met enkelvoudige fotonentelling om fotoluminescentie spectra, levensduren, anisotropie en kwantumrendementen van uw monsters te meten.
Keep in touch
Als u dit artikel met plezier hebt gelezen, en als eerste op de hoogte wilt zijn van het laatste nieuws, toepassingen en productinformatie van Edinburgh Instruments, meld u dan aan voor onze nieuwsbrief via de rode aanmeldknop hieronder, en volg ons op social media.