Sommige atomen zijn polairder dan andere doordat ze “gulziger” zijn naar elektronen.
Kijk maar eens naar het periodiek systeem, hoe rechter en hoger je gaat, hoe elektronegatiever atomen worden (de edelgassen niet meegerekend, want die hebben volle schillen en zijn “gelukkig” en hebben geen valentie-elektronen nodig).
Ik denk dat iedereen wel eens heeft gehoord dat bijvoorbeeld Flourine (F) een van de meest elektronegatieve elementen is, het zal letterlijk elektronen van waterstofatomen of koolstofatomen afscheuren. Zo ook Chloor (Cl)
Kijk eens naar deze afbeelding:
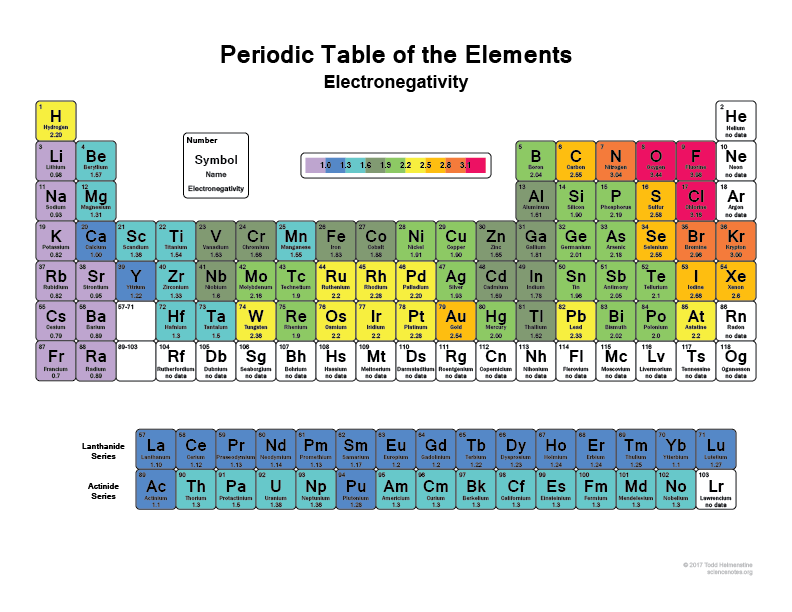
Daarom hebben sommige moleculen bij een binding superpolaire gebieden, omdat ze iets als Waterstof binden met iets als Flourine dat in principe gewoon de elektronen meestal bij zich heeft.
Deze vraag kan ook worden verklaard door het idee van elektronenwolken en het feit dat meer elektronegatieve atomen meestal meer elektronen bij zich hebben dan niet zo elektronegatieve atomen.

Dit wordt het dipoolmoment genoemd en zonder er al te diep op in te gaan zie je hoe de meeste elektronen dichter bij de zuurstof zitten dan bij de waterstof (omdat zuurstof elektronegatiever is dan waterstof)
Het woord elektronegatief klinkt soms trouwens contra-intuïtief maar het is electro-negatief in plaats van positief omdat in de chemie atomen die elektronen winnen een negatief teken hebben (voorbeeld: #Cl^-# is een chloor dat een elektron heeft gewonnen).